微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列限制条件下的离子一定可以大量共存的是
[? ]
A.由水电离出的c(H+) =1 ×10-13mol/L的溶液中:Al3+、K+、NO3-、SO42-
B.加水稀释时的值明显减小的溶液中:K+、Fe2+、I-、SO42-
C.加入Al能放出H2的溶液中:NH4+、SO42-、Cl-、HCO3-
D.加入二氧化锰固体可冒出气泡的溶液中:K+、Mg2+、I-、NO3-
参考答案:B
本题解析:
本题难度:一般
2、填空题 某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
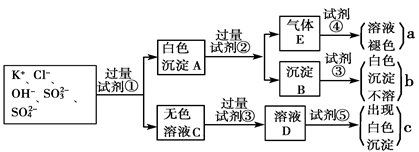
请回答下列问题:
(1)白色沉淀A与试剂②反应的离子方程式是__________________________________。
(2)无色溶液C中加入试剂③的主要目的是____________________________________。
(3)试验中若只加试剂③而不加试剂②,对实验的影响是_______________________。
(4)气体E通入试剂④发生反应的离子方程式是__________________________________。
参考答案:(1) BaSO3 + 2H+  Ba2+ + SO2↑ + H2O (2分)
Ba2+ + SO2↑ + H2O (2分)
(2) 中和OH-,防止对Cl-的检验产生干扰(2分)
(3) 会使SO32-对SO42-的检验产生干扰,不能确定SO42-和SO32-是否存在(2分)
(4) SO2 + Br2 + 2H2O  4H+ + SO42- + 2Br-(2分)
4H+ + SO42- + 2Br-(2分)
本题解析: 亚硫酸根离子和硫酸根离子都可以与钡离子反应生成白色沉淀,而亚硫酸钡沉淀不溶于水但能溶解在酸中,但硫酸钡沉淀既不溶解在水中,也不溶解在酸中。亚硫酸根离子在硝酸溶液中会被氧化为硫酸根离子,因此要检验硫酸根离子的存在时要先排除掉亚硫酸根离子对其的干扰,因此加的试剂1应为盐酸,
考点:
本题难度:困难
3、选择题 在无色透明的强酸性溶液中,能大量共存的是( )
A.Na+、NO3-、Al3+、Cl-
B.Na+、CO32-、K+、NO3-
C.Cu2+、K+、SO42-、Cl-
D.Ba2+、K+、Cl-、CO32-
参考答案:A.溶液无色,且四种离子在酸性条件下不发生任何反应,可大量共存,故A正确;
B.溶液无色,CO32-在酸性条件下不能大量共存,故B错误;
C.Cu2+有颜色,不符合题目无色要求,故C错误;
D.溶液无色,CO32-在酸性条件下不能大量共存,故D错误.
故选A.
本题解析:
本题难度:一般
4、选择题 在aLAl2(SO4)3和(NH4)2SO4的混合溶液分成两等分,一份加入bmol的BaCl2,恰好使溶液中的SO42-完全沉淀;另一份加入足量强碱并加热可得到cmolNH3,则原溶液中的Al3+的浓度(mol/L)为(? )
A.
B.
C.
D.
参考答案:D
本题解析:
【错解分析】错选C。忽略题中条件“溶液分成两等分”,溶质变为原来的1/2.
【正解】溶液中n(SO42-)=bmol,n(NH4+)=cmol,根据电荷守恒,n(Al3+)=(2b-c)/3,溶液体积分成两等分,所以原溶液中Al3+的浓度(mol/L)为 。
。
本题难度:简单
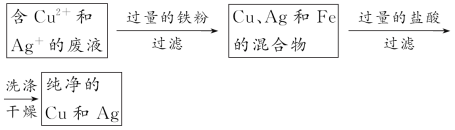
5、填空题 为防止环境污染和发生意外事故,实验过程中产生的废液不能随意倒入下水道。已知某次化学实验后,回收的废液中可能含有K+、Cu2+、Ag+等离子。
(1)为检验废水中是否含有Ag+,可以采用的试剂是 。如果溶液中确实存在Ag+,加入试剂后,将观察到的现象是
。
(2)实验证明,废液中确实存在上述三种离子。为回收Cu、Ag两种金属,实验时可以分别加入过量的 和 (填物质名称),充分反应后,经过 (填实验操作名称),可得到Cu和Ag。经过上述处理后的废水,进一步处理后即可以排放。
参考答案: (1)HCl(或盐酸盐) 有白色沉淀生成 (2)铁粉(或比铜活泼的金属) 稀盐酸 过滤
本题解析:(1)利用Ag+和Cl-反应生成不溶于稀硝酸或盐酸的AgCl白色沉淀来检验Ag+。
(2)回收Cu、Ag两种金属的流程如下:
考点:常见物质的检验、分离和提纯
本题难度:一般