微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化学用语表示正确的是
A.N2分子的电子式: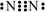
B.中子数为18的氯原子的原子符号: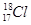
C.CH4分子的球棍模型:
D.HOCH2COOH缩聚物的结构简式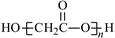
参考答案:A
本题解析:A、正确;B、中子数为18的氯原子的原子符号:3517Cl,错误;C、该图为比例模型,错误;D、酯化反应时羧基失去羟基,羟基失去氢,故为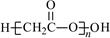 。
。
本题难度:简单
2、填空题 (12分)按要求写出下列有机物的相关化学用语:
(1)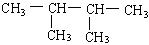 的系统命名:?
的系统命名:?
(2) 3-甲基-2-戊烯的结构简式:??
(3)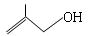 的分子式:?
的分子式:?
(4)分子式为C3H8O且属于醇类的同分异构体有?种;它们的结构简式为:?
参考答案:(1)2,3—二甲基丁烷
(2)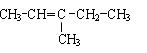
(3)C4H8O
(4)2,CH3CH(OH)CH3?CH3CH2CH2OH
本题解析:略
本题难度:一般
3、简答题 现有5.6g铁跟200ml HCl溶液恰好完全反应
(1)求生成氢气的体积(在标准状况下)?
(2)原盐酸的物质的量浓度?
参考答案:(1)5.6g铁的物质的量为5.6g56g/mol?=0.1mol,
令标准状况下,生成氢气的体积为V,则:
Fe+2HCl=FeCl2+H2↑
1mol? 22.4L
0.1mol? V
解得:V=0.1mol1mol×22.4L=2.24L.
答:5.6g铁跟HCl溶液恰好完全反应,标准状况下,生成氢气的体积为2.24L.
(2)5.6g铁跟200ml HCl溶液恰好完全反应,
5.6g铁的物质的量为5.6g56g/mol?=0.1mol,根据铁原子守恒,可知n(Fe)=n(FeCl2)=0.1mol,
再根据氯离子守恒可知n(HCl)=2n(FeCl2)=0.2mol,
所以原盐酸溶液物质的量浓度为0.2mol0.2L=1mol/L.
答:原盐酸溶液物质的量浓度为1mol/L.
本题解析:
本题难度:一般
4、选择题 在2009年10月1日,新的饮用矿泉水强制性国家标准《饮用天然矿泉水》正式实施,其中“溴酸盐(BrO3-)”这一潜在致癌物质被做了严格限制。有关专家解释,矿泉水在开采过程中会含有少量溴化物(Br-),在后续的生产过程中经臭氧(O3)处理逐渐转化成溴酸盐。下列有关该转化过程的认识正确的是(?)
A.该过程中溴化物(Br-)得到电子
B.该过程中臭氧(O3)是氧化剂,溴酸盐(BrO3-)是还原剂
C.该过程中溴元素被还原,氧元素被氧化
D.该过程中溴元素发生氧化反应,氧元素发生还原反应
参考答案:D
本题解析:在Br-中Br元素的化合价为-1价,在后续的生产过程中经臭氧(O3)处理逐渐转化成溴酸盐中的Br的化合价是+5价,该过程中溴化物(Br-)失去电子,被氧化,发生氧化反应,作还原剂,而臭氧(O3)中的氧元素得到电子,被还原,发生还原反应,作氧化剂。因此有关该转化过程的认识正确的是该过程中溴元素发生氧化反应,氧元素发生还原反应,选项正确的是D。
本题难度:一般
5、选择题 一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量饱和石灰水完全吸收,可得100克CaCO3沉淀,则完全燃烧1摩尔无水乙醇时放出的热量是( )
A.0.5Q
B.Q
C.2Q
D.5Q
参考答案:因生成的CO2用过量饱和石灰水完全吸收,可得100克CaCO3沉淀,
CaCO3的物质的量为100g100g/mol=1mol,
由碳元素守恒可知,二氧化碳的物质的量也为1mol,
即生成1mol二氧化碳放出的热量为Q,
而完全燃烧1摩尔无水乙醇时生成2mol二氧化碳,
则放出的热量为Q×2=2Q,
故选C.
本题解析:
本题难度:一般