微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 实验室用下图所示装置来制取乙酸乙酯,回答下列问题:

(1)请写出本实验中发生的主要反应方程式?。
(2)配置混合溶液时,加入试剂的正确顺序是?(填“A”或“B”)。
A.先加乙醇,再慢慢注入浓硫酸和乙酸? B.先加浓硫酸,再慢慢注入乙醇和乙酸
(3)浓硫酸的作用是?。
(4)饱和Na2CO3溶液的作用是?。
(5)实验完成后,右边试管液面上有透明的不溶于水的油状液体生成。若要分离10mL该液体混合物需要用到的主要玻璃仪器是?,这种分离方法叫做?。
参考答案:(8分)(1)CH3CH2OH+CH3COOH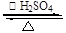 CH3COOCH2CH3+H2O?(2)A?
CH3COOCH2CH3+H2O?(2)A?
(3)催化剂和吸水剂?(4)中和乙酸,吸收乙醇,降低乙酸乙酯在水中的溶解度?(5)分液漏斗?分液
本题解析:(1)本实验中发生的主要反应方程式是乙酸与乙醇之间的酯化反应,方程式是CH3CH2OH+CH3COOH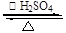 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.
(2)由于浓硫酸溶于水放热,而乙醇和乙酸均是易挥发的,所以配置混合溶液时,加入试剂的正确顺序是先加乙醇,再慢慢注入浓硫酸和乙酸,答案选A。
(3)浓硫酸的作用是催化剂,又因为该反应是可逆反应,浓硫酸还起到吸水剂的作用,有利于反应向正反应方向进行。
(4)由于生成的乙酸乙酯中含有乙酸和乙醇,所以饱和Na2CO3溶液的作用是中和乙酸,吸收乙醇,降低乙酸乙酯在水中的溶解度。
(5)由于乙酸乙酯不溶于水,可以通过分液法实现分离,所以要分离10mL该液体混合物需要用到的主要玻璃仪器是分液漏斗。
点评:该题是基础性实验题的考查,试题紧扣教材,基础性强,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生规范严谨的实验设计能力。明确实验原理,注意浓硫酸和碳酸钠的作用,注意相关知识的积累和总结。
本题难度:一般
2、选择题 下图是某烃的含氧衍生物的比例模型。该有机物是

A.C2H5OH
B.C6H5OH
C.CH3CHO
D.CH3COOH
参考答案:D
本题解析:略
本题难度:简单
3、选择题 关于苯乙烯(?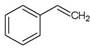 )的下列叙述,正确的是
)的下列叙述,正确的是
A.苯乙烯不可能发生加成反应
B.苯乙烯不可能使酸性高锰酸钾溶液褪色
C.苯乙烯不可能使溴的四氯化碳溶液褪色
D.苯乙烯可通过加聚反应生成高分子化合物
参考答案:D
本题解析:根据结构简式可知,分子中含有碳碳双键,所以能发生加成反应、氧化反应和加聚反应,选项A不正确,答案选D。
本题难度:简单
4、选择题 下列化合物中,显酸性的物质是(?)
A.CH2=CH—CH2OH
B.CH3COOH
C.CH2=CH—COOC2H5
D.CH3—CH—COOH
参考答案:BD
本题解析:A.CH2=CH—CH2OH 是醇类,无酸性;
B.CH3COOH ?D.CH3—CH—COOH都是羧酸类,有—COOH显酸性;
C. CH2=CH—COOC2H5是酯类,无酸性。?
选BD
本题难度:简单
5、填空题 硫酸工业生产应考虑综合经济效益问题。
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在____的郊区。(填选项的序号) A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1 t 98%的硫酸需消耗3.6×105kJ能量。请通过计算判断,若反应SO2(g)+1/2O2(g)=SO3(g);△H= -98.3kJ/mol-1放出的热量能在生产过程中得到充分利用,则每生产l t 98%的硫酸只需外界提供(或可向外 界输出)________千焦能量。
(3) CuFeS2是黄铁矿的另一成分,煅烧时,CuFeS2转化为CuO、Fe2O3,和SO2,该反应的化学方程式为
______________________。
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4 (由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)。

已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因
___________________
参考答案:(1)C
(2)6.23×103
(3) 4CuFeS2+ 13O2=4CuO+ 2Fe2O3+8SO2
(4)SO2转化为SO3是正反应放热的可逆反应,随温度升高,SO2的转化率减小;SO3物质的量减少,所以 CuSO4的量减少
本题解析:
本题难度:一般