| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《化学平衡》考点特训(2017年冲刺版)(六)
参考答案:C 本题解析:开始通入2mol SO2和2mol SO3气体,相当于4mol SO2和1molO2;A、比原来少通入2molSO2,故小于nmol;B、为等效平衡,等于nmol;C、相当于4mol SO2和2molO2,比原来多通入1mol氧气,平衡正向移动,故大于nmol;D、相当于4mol SO2和1molO2,等效平衡,等于nmol。 本题难度:一般 2、选择题 如下图所示:等温时,a、b容器开始体积相等,各充入等量的SO3(g),则平衡时SO3的转化率大小关系是 ( ) |
参考答案:B
本题解析:两容器的初始状态完全相同,但a容器为等容,b容器为等压,随着反应2SO3 2SO2+O2的进行,反应混合物的物质的量增大,a容器内压强增大,相对于b容器相当于加压,平衡左移,故a容器中SO3的转化率小,答案为B
2SO2+O2的进行,反应混合物的物质的量增大,a容器内压强增大,相对于b容器相当于加压,平衡左移,故a容器中SO3的转化率小,答案为B
本题难度:一般
3、填空题 (9分)在一定条件下,下列反应达到化学平衡:2HI(g) H2(g)+I2(g)(正反应为吸热反应)
H2(g)+I2(g)(正反应为吸热反应)
(1)如果升高温度,平衡混合物的颜色
(2)如果加入一定量的H2,平衡 移动
(3)如果使密闭容器的体积增大,平衡 移动
参考答案:(每空3分,共9分):(1)加深或变深 (2) 向左(向逆反应方向)(3)不
本题解析:略
本题难度:一般
4、选择题 下列有关反应限度的叙述正确的是( )
A.可逆反应达到平衡状态后,改变外界条件后,若反应速率发生变化,则平衡一定发生移动
B.大多数化学反应在一定条件都有一定限度
C.使用催化剂可降低反应活化能,加快反应速率,改变反应限度
D.FeCl3溶液与KSCN溶液反应达到平衡时,加入少量KCl固体,因K+,Cl-与溶液颜色无关,所以溶液颜色不会变化
参考答案:A、可逆反应达到平衡状态后,加入催化剂,反应速率发生变化,但是平衡一定不会发生移动,故A错误;
B、大多数化学反应在一定条件都有一定限度,最终达到化学平衡状态,故B正确;
C、用催化剂可降低反应活化能,同等程度加快正逆反应速率,但是不会改变反应限度,故C错误;
D、FeCl3溶液与KSCN溶液反应达到平衡时,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,K+和Cl-不参加反应,平衡不移动,溶液颜色无明显变化,故D正确.
故选:BD.
本题解析:
本题难度:一般
5、选择题 一氧化碳与氢气在催化剂作用下合成甲醇的反应为:CO(g)+2H2(g)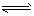 CH3OH(g)。在容积均为1L的a、b、c、d、e5个密闭容器中分别充入1mol CO和2mol H2等量混合气体,控温。实验测得相关数据如图,温度分别为300℃、500℃的密闭容器中,甲醇的物质的量与时间的关系;温度分别为T1~T5的密闭容器中,反应均进行到5min时甲醇的体积分数.下列有关说法正确的是
CH3OH(g)。在容积均为1L的a、b、c、d、e5个密闭容器中分别充入1mol CO和2mol H2等量混合气体,控温。实验测得相关数据如图,温度分别为300℃、500℃的密闭容器中,甲醇的物质的量与时间的关系;温度分别为T1~T5的密闭容器中,反应均进行到5min时甲醇的体积分数.下列有关说法正确的是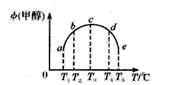
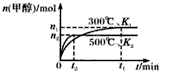
A.K1 < K2
B.该反应的正反应是气体体积减小的吸热反应
C.将容器c中的平衡态转变到容器d中的平衡态,可采取的措施有升温或减压
D.反应到5min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动
参考答案:C
本题解析:A、图1中,温度升高,甲醇的含量减少,可以判读反应为放热反应,不选A;B、由于反应是放热反应,不选B;C、将容器c中的平衡状态转变到容器d的平衡态,需要降低甲醇的含量,平衡逆向移动,可采取升温或减压,选C;D、反应进行到5分钟,T3达到平衡,a、b没有达到平衡,平衡正向移动,d、e达到了平衡,不选D。
考点:化学平衡图像分析。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《分子式、结.. | |