微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各溶液中,微粒的物质的量浓度关系正确的是?
A.Na2CO3溶液:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.NH4Cl溶液:c(NH4+)=c(Cl-)
C.硝酸钠与稀盐酸的混合溶液:c(Na+)=c(NO3-)
D.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
参考答案:C
本题解析:
正确答案:C
A.不正确,根据物料守恒可得:Na2CO3溶液:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
B.不正确,NH4Cl溶液:c(NH4+)<c(Cl-),NH4+ 部分水解
C.正确,硝酸钠与稀盐酸的混合溶液:c(Na+)=c(NO3-)
D.不正确,等体积等浓度的氢氧化钠与醋酸混合后溶液呈碱性:c(Na+)>c(CH3COO-)>c(OH-) >c(H+)
本题难度:一般
2、选择题 常温下,pH=3的醋酸溶液和pH=13的氢氧化钠溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应。下列说法不正确的是?
A.所用醋酸溶液的浓度大于所用氢氧化钠溶液的浓度
B.两溶液混合反应后的所得的混合溶液呈碱性
C.原醋酸溶液中有1%的醋酸已电离
D.反应后的溶液中CH3OO-与CH3COOH两种微粒的平衡浓度之和为0.05mol?L-1
参考答案:A
本题解析:醋酸溶液与氢氧化钠溶液等体积混合后恰好完全反应,由于二者是一元酸与一元碱的反应,所以醋酸与氢氧化钠溶液的浓度应该相等,A错误;恰好完全反应所得的溶液应该是醋酸钠溶液,由于醋酸根离子发生水解所以溶液呈碱性,B正确;假设体积均为1L,所以可以计算出混合前醋酸的浓度为0.1mol?L-1,根据其PH可以计算出电离出的氢离子浓度为0.001mol?L-1,醋酸的电离度为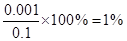 ,根据物料守恒可以得出反应前后醋酸根与醋酸分子的总的物质的量不发生变化,总的物质的量为0.1moL,等体积混合后体积变为原来的两倍,所以浓度变为原来的一半为0.05mol?L-1所以只有A错误,答案选A。
,根据物料守恒可以得出反应前后醋酸根与醋酸分子的总的物质的量不发生变化,总的物质的量为0.1moL,等体积混合后体积变为原来的两倍,所以浓度变为原来的一半为0.05mol?L-1所以只有A错误,答案选A。
本题难度:一般
3、选择题 25℃、101kPa时,下列哪个反应放出的热量能表示乙炔的燃烧热(单位:kJ/mol)
[? ]
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)
B.C2H2(g)+ O2(g)=2CO2(g)+H2O(l)
O2(g)=2CO2(g)+H2O(l)
C.C2H2(g)+ O2(g)=2CO(g) +H2O(g)
O2(g)=2CO(g) +H2O(g)
D.C2H2(g)+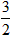 O2(g)=2CO(g) +H2O(l)
O2(g)=2CO(g) +H2O(l)
参考答案:B
本题解析:
本题难度:简单
4、选择题 已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是? ( )
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)= mol·L-1
mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
参考答案:C
本题解析:当a=b时,HA与BOH恰好完全反应生成正盐,由于HA与BOH的强弱未知,所以BA溶液的酸碱性不能确定,A错误;温度不一定是在25°C,B错误;KW=c(H+)·c(OH-),依据c(H+)= =
=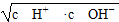 ,可知c(H+)=c(OH-),故溶液呈中性,C正确;D选项不论溶液显何性,依据电荷守恒均有c(H+)+c(B+)=c(OH-)+c(A-),错误。
,可知c(H+)=c(OH-),故溶液呈中性,C正确;D选项不论溶液显何性,依据电荷守恒均有c(H+)+c(B+)=c(OH-)+c(A-),错误。
本题难度:一般
5、填空题 (4分)取体积相同(25mL)的两份0.10mol·L-1NaOH溶液,将其中一份放在空气中一段时间后,溶液的PH ?(填“增大”、“减小”或“不变”),其原因是?。用已知浓度的盐酸中和上述两份溶液,若中和放置空气中一段时的那份消耗盐酸的体积为VA,另一份消耗盐酸的体积为VB,则
(1)以甲基橙为指示剂时,VA与VB的关系是?。
(2)以酚酞为指示剂时,VA和VB的关系是? ?。
?。
参考答案:减小;由于NaOH要与空气中的CO2反应生成Na2CO3,使NaOH的量减少,而使PH减小;VA=VB;? VA<VB
本题解析:略
本题难度:简单