微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.常温下某溶液中由水电离出的c(H+)=1×10-amol/L,若a<7时,则该溶液可能为NaHSO4溶液
B.中和同体积、同pH的硫酸、盐酸和醋酸所需相同浓度的NaOH溶液的体积关系:V(硫酸)>V(盐酸)=V(醋酸)
C.pH相等的①CH3COONa②C6H5ONa③NaHCO3溶液中,c(Na+)大小关系:②<③<①
D.已知 Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-4 mol·L-1的AgNO3溶液和1×10-4 mol·L-1 K2Cr04溶液混合,会有Ag2CrO4沉淀产生
参考答案:C
本题解析:A、常温下某溶液中由水电离出的c(H+)=1×10-amol/L,若a<7时,说明水的电离是被促进的,应该是能水解的盐溶液。NaHSO4溶液中水的电离被抑制,A不正确;B、盐酸与硫酸是强酸,醋酸是弱酸,因此中和同体积、同pH的硫酸、盐酸和醋酸所需相同浓度的NaOH溶液的体积关系:V(硫酸)=V(盐酸) <V(醋酸),B不正确;C、酸性强弱顺序是CH3COOH>H2CO3>C6H5OH,酸越弱水解程度越大,因此pH相等的①CH3COONa②C6H5ONa③NaHCO3溶液中,c(Na+)大小关系:②<③<①,C正确;D、等体积的1×10-4 mol·L-1的AgNO3溶液和1×10-4 mol·L-1 K2Cr04溶液混合,溶液中c2(Ag+)·c(CrO42-)=(5×10-5)2×5×10-5=1.25×10-13<1.12×10-12,因此得不到铬酸银沉淀,D不正确,答案选C。
本题难度:一般
2、填空题 7分)某温度(t℃)时,水的KW=1×10-13,则该温度(填大于、等于或小于)?25℃,理由是?。
将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
(1)若所得混合溶液为中性,则a:b=?;
(2)若所得混合溶液pH=2,则a:b=?。
参考答案:

本题解析:略
本题难度:一般
3、选择题 用A、B、C、D四种酸进行下列实验:
①pH=a的酸A,与pH=b的NaOH溶液等体积混合,混合后测得溶液的pH=7,且a+b>14
②B与NaCl不反应,能与Na2CO3反应生成CO2
③向浓度为10-3mol·L-1的C溶液滴加甲基橙试液时,溶液变成黄色
④酸D的钠盐不止一种,向两种D的钠盐水溶液中分别滴加紫色石蕊试液时,一个显红色,一个显蓝色
从上述实验数据和现象中,可以用来确定是弱酸的实验是( )
A.①③④? B.②③
C.②③④?D.全部
参考答案:A
本题解析:①若A为强酸,则 ;由于a+b>14,所以A为弱酸;②只能说明B的酸性比碳酸强,但不一定是强酸;③甲基橙的变色范围为3.1~4.4,小于3.1为红色,3.1到4.4之间为橙色,大于4.4为黄色,若C溶液为强酸溶液,则PH=3,溶液显红色,所以,C溶液为弱酸溶液;④若D酸为强酸,则将其两种钠盐溶液中滴加紫色石蕊试液时,一个显红色,一个溶液颜色不变;由此说明,酸D为弱酸;
;由于a+b>14,所以A为弱酸;②只能说明B的酸性比碳酸强,但不一定是强酸;③甲基橙的变色范围为3.1~4.4,小于3.1为红色,3.1到4.4之间为橙色,大于4.4为黄色,若C溶液为强酸溶液,则PH=3,溶液显红色,所以,C溶液为弱酸溶液;④若D酸为强酸,则将其两种钠盐溶液中滴加紫色石蕊试液时,一个显红色,一个溶液颜色不变;由此说明,酸D为弱酸;
本题难度:一般
4、选择题 已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
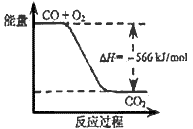
[? ]
A.CO的燃烧热为283 kJ
B.上图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023
参考答案:C
本题解析:
本题难度:一般
5、选择题 在水中加入下列粒子,不能破坏水的电离平衡的是
参考答案:D
本题解析:略
本题难度:简单