微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式中正确的是
A.氢氧化钠溶液吸收过量的二氧化碳OH-+CO2 = HCO3-
B.亚硫酸氢铵溶液与足量氨水反应HSO3-+ OH-= SO32-+ H2O
C.氯气通入冷水中 Cl2 +H2O = Cl-+ClO-+2H+
D.碳酸镁悬浊液中加醋酸CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
参考答案:A
本题解析:A:正确
B:氨水为弱碱,不能拆为离子,不正确
C:产物次氯酸为弱酸,不能拆为离子,排除
D:碳酸镁为不溶物,不能拆为离子,排除
答案为A
本题难度:困难
2、选择题 已知溶液中可发生反应:2FeBr2+?Br2=?2FeBr3,现向100mL的FeBr2溶液中通入3.36LCl2(标准状况),充分反应后测得溶液中Cl?和Br?的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为
A.2mol·L-1
B.1mol·L-1
C.0.4mol·L-1
D.0.2mol·L-1
参考答案:A
本题解析:根据反应式可知,亚铁离子的还原性强于溴离子的,所以氯气首先氧化的是亚铁离子。设溴化亚铁的物质的量是x,氯气的物质的量是0.15mol,则根据电子的得失守恒可知,x+(2x-0.15×2)×1=0.15×2,解得x=0.2mol,所以溴化亚铁的浓度是0.2mol÷0.1L=2.0mol/L,答案选A。
本题难度:困难
3、选择题 如果3.2 g XO2中含有0.1 mol的氧原子,则X的相对原子质量为
A.32
B.16
C.48
D.8
参考答案:A
本题解析:本题考查物质的量、摩尔质量及构成物质的粒子数之间的关系,可有多种解法。
设X原子的摩尔质量为M,
解法一:关系式法
XO2? —? 2O
M+16×2 g? 2 mol
3.2 g? 0.1 mol
M=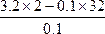 =32 g·mol-1
=32 g·mol-1
解法二:物质的量之比法
n(X)∶n(O)=  ∶0.1 mol=1∶2
∶0.1 mol=1∶2
M=32 g·mol-1。
解法三:公式法
M==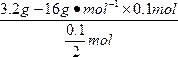 =32 g·mol-1
=32 g·mol-1
本题难度:简单
4、选择题 人体血红蛋白中含有Fe2+,如误食亚硝酸盐,会使Fe2+转变为Fe3+而使人中毒,服用维生素C可缓解亚硝酸盐的中毒,请据此判断维生素C可能具有 ( )
A.氧化性
B.还原性
C.酸性
D.碱性