微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 将128 g铜置入一定量的浓硝酸中,并微热,随着铜的不断减少,反应生成的气体颜色逐渐变浅,当铜反应完毕时(铜片完全消失),共收集到NO2和NO的混合气体44.8 L气体(标准状况),求:
(1)写出上述过程中,有关反应的化学方程式___________、_________________。
(2)完成该反应至少需要量取10 mol/L的浓硝酸_________mL。
(3)混合气体中NO2的体积为 ?、NO的体积为 ??。
参考答案:(1)Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O?
3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O
(2)600 mL
(3)V(NO2)= 22.4L? V(NO)=" 22.4L"
本题解析:(1) Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O?
3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O
注意方程式的配平,气体箭头符号。
(2)2Cu+6HNO3=2Cu(NO3)2+NO2↑+NO↑+3H2O
根据化学方程式,128 g铜即2molCu,可算出需要10 mol/L的浓硝酸: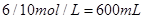
(3) NO2和NO的混合气体44.8 L(标准状况),,即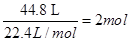 ,即
,即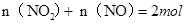 ①
①
而128g铜失去电子: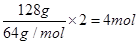 ,则
,则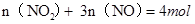 ?②,由①②可解出
?②,由①②可解出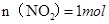 ,
,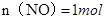 ,即
,即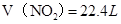 ,
, 。
。
点评:本题综合性较强,考查了铜与浓硝酸、稀硝酸反应的知识点,历年高考常考,计算时应抓住得失电子守恒,化繁为简。
本题难度:一般
2、选择题 在一定条件下,分别以高锰酸钾、氯酸钾和过氧化氢为原料制取氧气,当制得同温同压下相同体积的氧气时,三个反应中转移的电子数之比为( )
A.1:1:1
B.2:2:1
C.2:3:1
D.4:3:2
参考答案:B
本题解析:用高锰酸钾、氯酸钾制氧气,反应过程中O由-2价转化为0价,而用过氧化氢制氧气,O则由-1价转化为0价。现要制得同温同压下相同体积的O2,用过氧化氢制氧气的反应中转移的电子数是用高锰酸钾、氯酸钾制取氧气的反应中转移的电子数的一半。
本题难度:简单
3、选择题 在实验室中,常用KMnO4代替MnO2与浓盐酸反应制取氯气,其反应的化学方程式为?
2KMnO4+16HCl(浓)= 2MnCl2+5Cl2↑+2KCl+8H2O,下列叙述中正确的是(?)
A.反应中KMnO4被氧化
B.氧化产物与还原产物的物质的量之比为2﹕5
C.每生成1 mol Cl2时,反应中转移的电子为2 mol
D.每消耗16 mol HCl时,其中做氧化剂的HCl是10 mol
参考答案:C
本题解析:A、KMnO4中Mn元素化合价降低,所以KMnO4被还原,错误;B、氧化产物为Cl2,还原产物为MnCl2,物质的量之比为5::2,错误;C、根据化合价的变化可求出每生成1 mol Cl2时,反应中转移的电子为2 mol,正确;D、每消耗16 mol HCl时,其中做还原剂的HCl是10 mol,错误。
本题难度:一般
4、选择题 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于4区的是
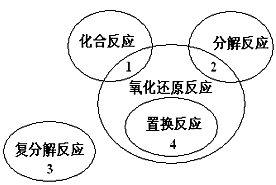
[? ]
A.Cl2+2KBr===Br2+2KCl
B.2NaHCO3====Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.2Na2O2+2CO2===2Na2CO3+O2
参考答案:A
本题解析:
试题分析:
解:A.该反应符合置换反应概念,所以属于置换反应,故A正确;
B.该反应中,反应物和生成物都没有单质,所以不属于置换反应,该反应为分解反应,故B错误;
C.该反应生成物中没有单质,所以不属于置换反应,属于化合反应,故C错误;
D.该反应反应物中没有单质,所以不属于置换反应,但属于氧化还原反应,故D错误;
故选A.
本题难度:简单
5、填空题 一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu===2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-===Cu2+,还原反应式:2Fe3++2e-="==" 2Fe2+。据此,回答下列问题:?
⑴将反应Zn+2H+ ="==" Zn2++H2↑拆写为两个“半反应式”:
氧化反应式:?,还原反应式:?。
⑵将反应3NO2+H2O ="=" 2H++2NO3—+NO拆写为两个“半反应式”:
氧化反应式:?,还原反应式:?。
⑶已知某反应的两个“半反应式”为:CH4+10 OH--8e-===CO32-+7H2O,O2+2H2O+4e-="==" 4OH—,则氧化还原反应方程式为?。
参考答案:⑴Zn-2e-="==" Zn2+,2 H++2e-="==" H2。
⑵2NO2+2H2O-2e-="==" 4H++2NO3-;NO2+2H++2e-="==" NO+H2O
 ? ⑶CH4+2O2+2OH—="==" CO32-+3H2O
? ⑶CH4+2O2+2OH—="==" CO32-+3H2O
本题解析:⑵注意电子得失守恒、粒子数目守恒以及物质的选择与系数调整。在反应3NO2+H2O ===2H++2NO3—+NO中,只有1个NO2分子作氧化剂,有2个NO2分子作还原剂。2个NO2分子变为2个NO3-离子时,需2个H2O分子提供2个O原子,2个 H2O分子中的4个H原子则变为4个 H+离子。1个NO2分子变成1个NO分子时,另1个O原子需要与2个 H+离子结合成水。所以,有以上“半反应”。⑶前式+后式×2即得
本题难度:一般