微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定温度下将1mol CO和3mol水蒸气放在密闭的容器中发生下列反应:
CO(g)+H2O(g)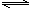 CO2(g)+H2(g)
CO2(g)+H2(g)
达到平衡后,测得 CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为
[? ]
A.1.2mol
B.1.5mol
C.1.8mol
D.2.5mol
参考答案:C
本题解析:
本题难度:一般
2、填空题 (8分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
□SiO2+□C+□N2 □Si3N4+□CO
□Si3N4+□CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)若知上述反应为放热反应,则其反应热△H 零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);
(4)若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
(5)若已知CO生成速率为v(CO)=18mol/(L.min),则N2消耗速速率为v(N2)= mol/(L.min)。
参考答案:(1)3,6,2,1,6(2分)
(2)N2,Si3N4?(3)小于?减小?(4)逆?(5)6(每空1分)
本题解析:(1)反应中碳元素的化合价从0价升高到+2价,失去2个电子;氮元素的化合价从0价降低到-3价,得到3个电子。所以根据电子的得失守恒可知,还原剂和氧化剂的物质的量之比是3︰1,所以配平后的化学计量数分别依次是3,6,2,1,6。
(2)根据(1)可知氮气是氧化剂,其还 原产物是Si3N4。
(3)放热反应的△H小于0。升高温度平衡向吸热的逆反应方向移动,因此平衡常数减小。
(4)根据配平后的方程式可知,正反应是体积增大的,所以增大压强,平衡向逆反应方向移动。
(5)根据反应速率之比是相应的化学计量数之比可知,氮气的消耗速率是18mol/(L.min)÷3=6mol/(L.min)。
本题难度:一般
3、选择题 反应CO(g)+H2O(g)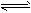 CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数
K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表

此时反应中正、逆反应速率的关系式是
[? ]
A.v(正)>v(逆)
B.v(正)<v(逆)
C.v(正)=v(逆)
D.无法判断
参考答案:A
本题解析:
本题难度:一般
4、选择题 可逆反应2SO2+O2 ?2SO3在密闭容器中达到了平衡,下列说法正确的是
?2SO3在密闭容器中达到了平衡,下列说法正确的是
A.SO2和O2不再化合,反应停止了
B.容器内压强保持不变
C.SO2、O2和SO3的浓度相等
D.SO2、O2和SO3的物质的量之比为2:1:2
参考答案:B
本题解析:略
本题难度:简单
5、选择题 一定温度下,反应N2(g)+3H2(g) 2NH3(g)的反应热和化学平衡常数分别为△H和K, 则相同温度时反应4NH3(g)
2NH3(g)的反应热和化学平衡常数分别为△H和K, 则相同温度时反应4NH3(g) 2N2(g)+6H2(g)反应热和化学平衡常数为(? )
2N2(g)+6H2(g)反应热和化学平衡常数为(? )
A.2△H和2K
B.-2△H和 K2
C.-2△H和 K-2
D.2△H和-2K
参考答案:C
本题解析:反应热和化学计量数成之比,即反应热是-2△H;平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,选项C正确,答案选C。
本题难度:简单