微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关平衡常数的说法中,正确的是(?)
A.改变条件,反应物的转化率增大,平衡常数也一定增大
B.反应2NO2(g)  N2O4(g) △H<0,升高温度该反应平衡常数增大
N2O4(g) △H<0,升高温度该反应平衡常数增大
C.对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D.平衡常数为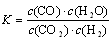 的反应,化学方程式为CO2+H2
的反应,化学方程式为CO2+H2 CO+H2O
CO+H2O
参考答案:D
本题解析:
正确答案:D
A.不正确,平衡常数不一定增大,与反应的计量数有关;
B.不正确,反应2NO2(g)  ?N2O4(g) △H<0,升高温度平衡逆向移动,该反应平衡常数变小;
?N2O4(g) △H<0,升高温度平衡逆向移动,该反应平衡常数变小;
C.不正确, 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数互为倒数。
D、正确。
本题难度:一般
2、填空题 (16分)平衡指的是两个相反方向的变化最后所处的运动状态;在平衡时,两种变化仍在继续进行,但是它们的速率相等;根据变化的性质可分为物理平衡和化学平衡,中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等等。
(1)现有容积为1 L的恒温恒容密闭容器,向其中加入2 mol A气体和2 mol B气体后发生如下反应:
A(g) + B(g)  ?C(g)?△H= - a kJ·mol-1
?C(g)?△H= - a kJ·mol-1
20s后,反应达到平衡状态,生成1 mol C气体,放出热量Q1kJ。回答下列问题。
①计算20s内B气体的平均化学反应速率为___________,写出该反应的平衡常数表达式___________。
②保持容器温度和容积不变,若改为向其中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1 与Q2的相互关系正确的是____________(填字母)。
(A)Q1 + Q2 = a?(B) Q1 + 2Q2 < 2a?(C)Q1 + 2Q2 > 2a?(D)Q1 + Q2 < a
③在原平衡基础上,保持容器温度和容积不变,向容器中再通入b mol A气体(b>0)时,v(正)_____v(逆)(填“>”、“<”或“=”),重新达平衡后,C气体的平衡体积分数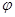 (C) =
(C) = 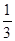 ,则b = ____________。
,则b = ____________。
(2)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。回答下列问题。(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值_____20.00(填“>”、“<”或“=”),而溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为_____________________________________________。
②如果V=40.00,则此时溶液中c(OH-) - c(H+) - c(CH3COOH)= ___________________mol·L-1。
参考答案:(16分)
(1)①0.05mol/(L·s)(1分),K=c(C)/[c(A) ·c(B)](2分)。
②C(2分)。
③ >(2分),4/3或1.33(2分)。
(2)①<(2分),c(Na+) = c(CH3COO-) > c(H+) = c(OH-) (3分)。
② 1/30或0.033(2分)
本题解析:(1)根据A(g) + B(g)  ?C(g),生成1 mol C气体,则消耗1 mol B气体,
?C(g),生成1 mol C气体,则消耗1 mol B气体,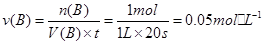 ,化学平衡常数即生成物的浓度与反应物浓度之比,不要忘记系数的次方,K=c(C)/[c(A) ·c(B)];2 mol A气体和2 mol B气体生成1 mol C气体,放出热量Q1kJ,加入1molC气体,则转化的C气体比0.5 mol要多,即吸收的热量比Q1/2大,所以Q1 + 2Q2 > 2a;增加反应物浓度,v(正)大于v(逆),设加入的b mol气体A转化了x mol,则
,化学平衡常数即生成物的浓度与反应物浓度之比,不要忘记系数的次方,K=c(C)/[c(A) ·c(B)];2 mol A气体和2 mol B气体生成1 mol C气体,放出热量Q1kJ,加入1molC气体,则转化的C气体比0.5 mol要多,即吸收的热量比Q1/2大,所以Q1 + 2Q2 > 2a;增加反应物浓度,v(正)大于v(逆),设加入的b mol气体A转化了x mol,则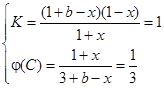 可以求出
可以求出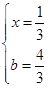
(2)可以假设氢氧化钠是20mL,此时恰好中和,溶液中只有醋酸钠,呈碱性,所以pH=7时,氢氧化钠体积小于20mL。根据溶液中的电荷守恒可知c(Na+) = c(CH3COO-) > c(H+) = c(OH-)。当V=40mL时,溶液中溶质是CH3COOH和CH3COONa;根据电荷守恒和物料守恒关系,可以推断:c(OH-) - c(H+) - c(CH3COOH)= c(Na+) =0.033 mol·L-1
点评:综合性强,难度较大。
本题难度:一般
3、选择题 下图是关于反应A2(g)+3B2(g) 2C(g)(正反应为放热反应)的平衡移动图像,影响平衡移动的原因可能是( )
2C(g)(正反应为放热反应)的平衡移动图像,影响平衡移动的原因可能是( )

A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时使用催化剂
参考答案:C
本题解析:由图可知改变的条件可使v(正)增大v(逆)减小,只有C符合该变化。
本题难度:一般
4、选择题 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表
物质
| X
| Y
| Z
|
初始浓度/mol·L—1
| 0.1
| 0.2
| 0
|
平衡浓度/mol·L—1
| 0.05
| 0.05
| 0.1
|
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X + 3 Y  ?2 Z,其平衡常数为1600
?2 Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
参考答案:C
本题解析:反应达平衡时,X的转化率为0.05÷0.1=0.5,即50%,选项A正确;根据表中数据可知,平衡时X的浓度减少0.05mol/L,Y的浓度减少0.15mol/L,而Z的浓度增加0.1mol/L,所以根据物质的变化量之比是相应的化学计量数之比可知,该反应的方程式是X(g) + 3Y(g) 2Z(g)。化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数是
2Z(g)。化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数是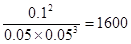 ,所以选项B正确;正反应是体积减小的,所以增大压强平衡向正反应方向移动,但平衡常数是不变的,即选项C不正确;平衡常数与温度有关系,所以选项D正确,因此答案选C。
,所以选项B正确;正反应是体积减小的,所以增大压强平衡向正反应方向移动,但平衡常数是不变的,即选项C不正确;平衡常数与温度有关系,所以选项D正确,因此答案选C。
本题难度:一般
5、选择题 下列事实,不能用勒夏特列原理解释的是
A.氯水中有下列平衡:Cl2+H2O HCl + HClO,当加入AgNO3溶液后,溶液颜色变浅
HCl + HClO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g)  H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深
C.反应CO+NO2  CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施(N2+3H2 2NH3;DH<0)
2NH3;DH<0)
参考答案:B
本题解析:勒夏特列原理适应于可逆反应,当系统的条件改变时所遵循的原理;
A.当加入AgNO3溶液后,银离子消耗了氯离子,产物浓度减少,平衡右移,氯气的浓度减少,溶液颜色变浅,符合勒夏特列原理
B.反应2HI(g)  H2(g)+I2(g)属于两连气体系数相等的可逆反应,增大压强平衡并不发生移动,但由于体系体积减小,各物质的浓度均增大,体系颜色一样变深,但并不能用勒夏特列原理来解释,符合题意
H2(g)+I2(g)属于两连气体系数相等的可逆反应,增大压强平衡并不发生移动,但由于体系体积减小,各物质的浓度均增大,体系颜色一样变深,但并不能用勒夏特列原理来解释,符合题意
C.升高温度可使平衡向吸热反应方向移动,符合勒夏特列原理
D.降低温度,可逆反向放热反应方向移动,可得到更多的氨气,符合勒夏特列原理
故答案为B
本题难度:简单