微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 将下列粒子的符号填入相应的空格内:O2、NH3、CO2、H2O、N2、(NH4)2SO4、SiCl4。
(1)存在极性键的极性分子是____。
(2)存在非极性键的非极性分子是____。
(3)存在极性键的非极性分子是____。
(4)全部由非金属元素组成的离子化合物是____。
参考答案:(1)NH3、H2O
(2)O2、N2
(3)CO2、SiCl4
(4)(NH4)2SO4
本题解析:
本题难度:一般
2、选择题 下列化合物中既有离子键又有共价键的是( )
A.NaOH
B.H2S
C.CaCl2
D.H2O2
参考答案:A
本题解析:
本题难度:一般
3、选择题 A、B两元素可形成AB型离子化合物,如果A、B两种离子的核外电子数之和为20,则A、B两元素所在的周期可以是( )
A.两种元素在同一个周期
B.一种在第一周期,一种在第二周期
C.一种在第二周期,一种在第三周期
D.一种在第三周期,一种在第四周期
参考答案:C
本题解析:
本题难度:一般
4、填空题 氮、磷、锌、铁等是与生命活动密不可分的元素。请回答下列问题:
(1) NH3和PH3都是极性分子,其中极性较大的是______,理由是?。
(2) 20mL0.1 mol·L-1次磷酸(H3PO2)溶液与20 mL 0.1 mol·L-1 NaOH溶液恰好中和生成正盐,则H3PO2的结构式是?。
(3) 下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式
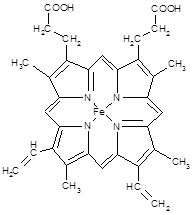 ?
?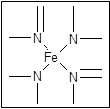
血红素中N原子的杂化方式为?,在右图的方框内用“→”标出Fe2+的配位键。
(4) N2与CO互为等电子体。下表是两者的键能
数据(单位:kJ·mol-1):
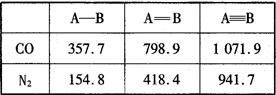
结合数据说明CO比N2活泼的原因:_____。
(5) Zn2+基态时的电子排布式是______,ZnO和ZnS的晶体结构相似,其中熔点较高的是______,理由是?。
参考答案:(1)NH3;N的电负性大于P
(2)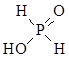
(3)sp3杂化;sp2杂化;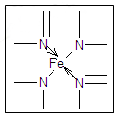
(4)断裂第一个π键消耗能量:CO? 273KJ/mol 小于 N2?523.3 KJ/mol,CO中的第一个π键更容易断裂,故CO比N2活泼
(5)[Ar]3d10;ZnO; 同属于离子晶体,O2-半径小于S2-,故ZnO晶格能大(或离子键强),熔点高
本题解析:(1)因为N的电负性大于P,故 NH3的极性较大;(2)20mL0.1 mol·L-1次磷酸(H3PO2)溶液与20 mL 0.1 mol·L-1 NaOH溶液恰好中和生成正盐,二者物质的量之比为1:1,故H3PO2为一元酸,故其结构应为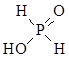 。(3)根据N原子的价电子排布式2s22p3,若N原子形成3个共价键,则氮原子周围还有一对孤对电子,即此时无配位键,该氮原子为sp3杂化,若N原子形成4个共价键,则必有一个是配位键,若还存在双键(双键视为单键),则该氮原子为sp2杂化;含有双键的氮原子存在孤对电子,可形成配位键,如图所示
。(3)根据N原子的价电子排布式2s22p3,若N原子形成3个共价键,则氮原子周围还有一对孤对电子,即此时无配位键,该氮原子为sp3杂化,若N原子形成4个共价键,则必有一个是配位键,若还存在双键(双键视为单键),则该氮原子为sp2杂化;含有双键的氮原子存在孤对电子,可形成配位键,如图所示 。
。
(4)根据所给数据可知断裂第一个π键消耗能量:CO为273KJ/mol 小于 N2为523.3 KJ/mol,即CO中的第一个π键更容易断裂,故CO比N2活泼。(5) Zn为30号元素,基态时的电子排布式是[Ar]3d104s2,故Zn2+基态时的电子排布式是[Ar]3d10,ZnO和ZnS同属于离子晶体,O2-半径小于S2-,故ZnO晶格能大(或离子键强),熔点高。
本题难度:一般
5、选择题 在单质的晶体中,一定不存在
[? ]
A.离子键
B.分子间作用力
C.共价键
D.金属键
参考答案:A
本题解析:
本题难度:简单