微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2.E的阳离子与A的阴离子核外电子层结构完全相同.
回答下列问题:
(1)五种元素的名称:A______,B______,C______,D______,E______.
(2)B、C、D元素的原子半径由大到小的顺序为______,它们的最高价氧化物对应水化物的酸性强弱顺序为______.
(3)写出C单质在足量A单质中燃烧后的产物与D单质同时通入水中的化学方程式______.
(4)A与E形成的化合物的化学式是______,它的性质决定了它在物质的分类中应属于______.
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量时,观察到的现象是______,有关反应的离子方程式为______.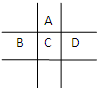
参考答案:(1)设C的原子序数为x,则A为x-8,B为x-1,C为x+1,A、B、C、D四种元素原子核外共有56个电子,则有x+x-8+x-1+x+1=56,x=16,所以C为S元素,A为O元素,B为P元素,D为Cl元素,1molE单质与足量酸作用,在标准状况下能产生33.6LH2,可知E的化合价为+3价,应为Al元素,
故答案为:氧;磷;硫;氯;铝;
(2)同周期元素从左到右原子半径逐渐减小,r(P)>r(S)>r?(Cl)则有元素的非金属性逐渐增强,对应的最高价氧化物对应水化物的酸性逐渐增强,则有HClO4>H2SO4>H3PO4,
故答案为:r(P)>r(S)>r?(Cl);HClO4>H2SO4>H3PO4;
(3)C单质在足量A单质中燃烧后的产物为SO2,具有还原性,与Cl2在水中发生氧化还原反应生成H2SO4和HCl,反应的方程式为SO2+Cl2+2H2O═H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O═H2SO4+2HCl;
(4)A与E形成的化合物为Al2O3,属于两性氧化物,故答案为:Al2O3;两性氧化物;
(5)D与E形成的化合物为AlCl3,加入NaOH溶液,发生Al3++3OH-═Al(OH)3↓,有白色沉淀生成,Al(OH)3具有两性,继续加入NaOH溶液,进一步反应生成NaAlO2和水,反应的离子方程式为?Al(OH)3+OH-═AlO2-+2H2O,
故答案为:有白色沉淀生成,当达到最大量时又逐渐减少,最终沉淀完全消失,变成澄清溶液;Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
本题解析:
本题难度:一般
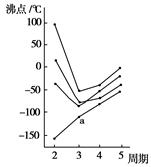
2、选择题 如图所示每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是( )
A.H2S
B.HCl
C.PH3
D.SiH4
参考答案:D
本题解析:a曲线表示氢化物的沸点随原子序数的增大而升高,并没有出现反常现象,说明不存在氢键,由于氨气、水和HF都存在氢键,因此a曲线表示的是第ⅣA元素的氢化物,答案选D。
本题难度:一般
3、选择题 CoCl3·4NH3用H2SO4溶液处理再结晶,SO42-可以取代化合物中的Cl-,但NH3的含量不变,用过量的AgNO3处理该化合物,有氯总量的1/3以AgCl析出,这种配合物应该表示为:
A.[Co(NH3)4]Cl3
B.[Co(NH3)4Cl3]
C.[Co(NH3)4Cl]Cl2
D.[Co(NH3)4Cl2]Cl
参考答案:D
本题解析:根据有1/3的氯能生成AgCl;说明有两个氯做配体与中心原子结合;一个氯为自由的氯离子;故答案为D。
本题难度:一般
4、选择题 下列说法中正确的是( )
A.酸性氧化物都是非金属氧化物
B.所有物质中都存在化学键
C.含有极性键的分子一定是极性分子
D.含有离子键的化合物一定是离子化合物
参考答案:A、酸性氧化物也可能是金属氧化物,如:Mn2O7是酸性氧化物,故错误.
B、稀有气体都是单原子分子,不存在化学键,只存在分子间作用力,故错误.
C、二氧化碳分子中含有极性键,但二氧化碳中正负电荷的重心重合,电荷分布均匀,为非极性分子,故错误.
D、离子化合物一定含有离子键,可能含有共价键,所以含有离子键的化合物一定是离子化合物,故D正确.
故选D.
本题解析:
本题难度:一般
5、选择题 以下说法正确的是
[? ]
A.共价化合物内部可能有极性键和非极性键
B.原子或离子间相互的吸引力叫化学键
C.非金属元素间只能形成共价键
D.金属元素与非金属元素的原子间只形成离子键
参考答案:A
本题解析:
本题难度:简单