微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列事实中,不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O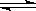 HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g) 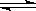 H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深
C.反应CO+NO2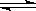 CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动
CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动
D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
参考答案:B
本题解析:略
本题难度:一般
2、填空题 (10分)在一定温度时向一个容积不变的容器中加入3 mol PCl3和4 mol Cl2使之反应
PCl3(g)+ Cl2(g) PCl5(g) 反应达到平衡时容器的压强为开始时的6/7,则此时。
PCl5(g) 反应达到平衡时容器的压强为开始时的6/7,则此时。
(1)容器的密度为开始时______倍;气体的平均相对分子质量为开始时______倍。
(2)保持恒温,将起始物改为a mol PCl3,b mol Cl2,c mol PCl5,欲使平衡时PCl5的体积分数1/6,则a、b、c(分别用含a、b和b、c的两个代数式表示)的关系为?、?。欲使反应向逆方向进行,a的取值范围?;c的取值范围?。
参考答案:(10分)(1)1(2分)、7/6 (2分)(2)a+ c=3(1分)? b+ c=4(1分)、
0≤a<2(2分)、1<c≤3(2分)
本题解析:(1)密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以密度是不变的。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的。由于温度和容器容积不变,所以根据平衡时容器的压强为开始时的6/7,则此时气体的物质的量也是反应前的6/7,所以气体的平均相对分子质量为开始时7/6倍。
(2)? PCl3(g)+ Cl2(g) PCl5(g)
PCl5(g)
起始量(mol)? 3?4? 0
转化量(mol)? x? x? x
平衡量(mol)? 3-x? 4-x? x
所以有(3-x+4-x+x)/7=6/7
解得x=1
所以平衡时PCl5的体积分数1/6。由于反应前后容器容积和温度是不变的,因此要使平衡时PCl5的体积分数1/6,则根据等效平衡的原理可知,等效转化后,对应各物质起始投料的物质的量与原平衡起始态相同,所以a+c=3、b+c=4。由于平衡时三氯化磷的物质的量是2mol、五氯化磷的物质的量是1mol,所以欲使反应向逆方向进行,则a的取值范围是0≤a<2、1<c≤3。
点评:所谓等效平衡是指外界条件相同时,同一可逆反应只要起始浓度相当,无论经过何种途径,都可以达到相同的平衡状态。等效平衡的判断及处理一般步骤是:进行等效转化——边倒法,即按照反应方程式的计量数之比转化到同一边的量,与题干所给起始投料情况比较。等效平衡一般有三种类型:I类:恒温恒容下对于反应前后气体体积发生变化的反应来说(即△n≠0的体系):等效转化后,对应各物质起始投料的物质的量与原平衡起始态相同。II类:恒温恒容下对于反应前后气体体积没有变化的反应来说(即△n=0的体系):等效转化后,只要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。III类:恒温恒压下对于气体体系等效转化后,要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。解答该类型试题的关键是分清类别,用相应的方法求解即可。
本题难度:一般
3、选择题 在容积固定的密闭容器中进行的可逆反应2NO2  ?N2O4达到平衡的标志是( )
?N2O4达到平衡的标志是( )
A.反应停止了
B.容器内气体颜色不变
C.容器内气体总质量不变
D.容器内气体密度不变
参考答案:B
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,A不正确。颜色深浅和浓度有关系,所以B正确。根据质量守恒定律可知,气体的质量始终是不变的,C不正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,D不正确。答案选B。
本题难度:一般
4、选择题 在一定温度下,向容积固定不变的密闭容器中充入a mol PCl5,发生如下反应:
PCl5(g) ?PCl3(g)+Cl2(g);达平衡后再向容器中充入amol PCl5,再次达到平衡后,与原平衡比较,下列叙述不正确的是 (?)
?PCl3(g)+Cl2(g);达平衡后再向容器中充入amol PCl5,再次达到平衡后,与原平衡比较,下列叙述不正确的是 (?)
A.混合气体的密度增大
B.相对平均分子质量增大
C.PCl5的转化率提高
D.PCl5的质量分数增大
参考答案:C
本题解析:TV不变时,平衡体系中向容器中充入amol PCl5,向正向移动,质量增加体积不变,密度增加。物质的量增加,质量也增加,摩尔质量不变。加入PCl5, PCl5的转化率反而减小,但是质量分数增加。
本题难度:简单
5、计算题 某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
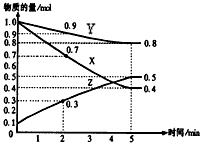
(1)由图中的数据分析,该反应的化学方程式为___________________
(2)反应开始至2min、5minZ的平均反应速率为_______________、________________;
(3)5min后Z的生成速率比5min末Z的生成速率_______________(大、小、相等)。
参考答案:(1)3X+Y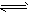 2Z
2Z
(2)0.05 mol·(L·min)-1;0.04 mol·(L·min)-1
(3)相等
本题解析:
本题难度:一般