微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各项中的两种物质在溶液中的反应可用同一离子方程式表示的是(?)
A.醋酸与氢氧化钠、盐酸与氢氧化钡溶液
B.碳酸钠与足量盐酸、碳酸氢钾与足量稀硫酸
C.硫酸与氢氧化钡溶液、NaHSO4溶液中滴入少量Ba(OH)2
D.碳酸钠与澄清石灰水、碳酸氢钠与澄清石灰水
参考答案:C
本题解析:NaHSO4与少量Ba(OH)2溶液作用,其化学方程式为:NaHSO4+Ba(OH)Ba(OH)2电离出的Ba2+、OH-完全反应,其离子方程式表示为:
2H++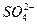 +Ba2++2OH-====BaSO4↓+2H2O
+Ba2++2OH-====BaSO4↓+2H2O
2====BaSO4↓+2H2O+Na2SO4
本题难度:简单
2、选择题 下列反应可用离子方程式H++OH-=H2O表示的是( )
A.盐酸和氨水反应
B.稀硫酸和氢氧化钡溶液反应
C.硝酸和氢氧化钠溶液反应
D.醋酸和氢氧化钠溶液反应
参考答案:A、盐酸和氯化氢反应生成了铵离子和水,反应的离子方程式为:NH3?H2O+H+═NH4++H2O,不能够用离子方程式H++OH-=H2O表示,故A错误;
B、稀硫酸和氢氧化钡反应生成了硫酸钡和水,反应的离子方程式为:2H++3OH-+SO42-+Ba2+═BaSO4↓+2H2O,不能够用离子方程式H++OH-=H2O表示,故B错误;
C、硝酸和氢氧化钠都是可溶性的强电解质,反应生成了水和可溶性的硝酸钠,反应可用离子方程式H++OH-=H2O表示,故C正确;
D、醋酸是弱酸,离子方程式中保留分子式,反应的离子方程式为:CH3COOH+OH-=CH3COO-+H2O,不能够用离子方程式H++OH-=H2O表示,故D错误;
故选C.
本题解析:
本题难度:简单
3、选择题 下列离子方程式的书写正确的是( )
A.氢氧化钡溶液与等物质的量的稀硫酸混合:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O
B.玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-=Na2SiO3↓+H2O
C.高锰酸钾酸性溶液吸收二氧化硫:SO2+MnO4-+4H+=SO42-+Mn2++2H2O
D.从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
参考答案:A、拆分及配比均符合,故A正确;
B、Na2SiO3是易溶于水易电离的物质,应写成离子形式,故B错误;
C、得失电子不守恒,故C错误;
D、酸性条件下不可能存在OH-,故D错误;
故选:A.
本题解析:
本题难度:简单
4、简答题 甲同学在0.5mol/L的FeCl3溶液中滴加0.1mol/LKI溶液即呈现红棕色,再加入CCl4振荡后静置,可观察到CCl4层呈紫色.乙同学在0.5mol/L的FeCl3溶液中先滴加4mol/LNH4F溶液,发现FeCl3溶液渐渐褪至无色,而后再加入0.1mol/LKI溶液,不呈红棕色,再加CCl4振荡,静置,也观察不到CCl4层有紫红色出现.
(1)甲同学的实验说明FeCl3溶液和KI溶液发生了反应,用离子方程式表示______
(2)乙同学在实验中观察不到甲同学的实验现象,其原因分析合理的是______
A.Fe3+被F-还原成Fe2+,使溶液中不再存在Fe3+
B.Fe3+与F-结合成难电离物质,不再和I-结合
C.I-、F-、F-、NH4+结合成难电离的物质,不再和Fe3+反应
(3)乙同学所用的NH4F溶液是用塑料瓶盛装的,可否改用玻璃瓶______(填能与否),其原因是:NH4F溶液水解生成HF,NH4++H2O?NH3?H2O+HF,______.
参考答案:(1)FeCl3溶液中滴加KI溶液即呈现红棕色,再加入CCl4振荡后静置,可观察到CCl4层呈紫色,生成碘,即铁离子与碘离子发生氧化还原反应,其离子反应为2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2;
(2)FeCl3溶液中先滴加NH4F溶液,发现FeCl3溶液渐渐褪至无色,而后再加入KI溶液,不呈红棕色,再加CCl4振荡,静置,也观察不到CCl4层有紫红色出现,则说明铁离子与氟离子结合生成难电离的物质,所以不能再与碘离子发生氧化还原反应,只有B符合,故答案为:B;
(3)铵根离子水解生成HF,HF酸能与玻璃中的二氧化硅反应,所以不能用玻璃瓶盛放NH4F溶液,故答案为:否;氢氟酸会腐蚀玻璃.
本题解析:
本题难度:一般
5、选择题 下列反应的离子方程式书写正确的是( )
A.硫酸氢钾溶液与氢氧化钠溶液反应:H++OH-=H2O
B.稀硫酸与铁粉反应:2Fe+6H+=2Fe3++3H2↑
C.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓
D.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
参考答案:A、硫酸氢钾溶液能完全电离出氢离子,显示酸性,能与氢氧化钠溶液反应,反应实质是H++OH-=H2O,故A正确;
B、金属铁和硫酸反应生成亚铁盐和氢气,实质是:Fe+2H+=Fe2++H2↑,故B错误;
C、氢氧化钡和硫酸反应生成硫酸钡和水,反应的实质是:2H++-+2OH-+Ba2++SO42-=BaSO4↓+2H2O,故C错误;
D、碳酸钙是难溶的盐,不能拆成离子,方程式为:CaCO3+2H+=H2O+CO2↑+Ca2+,故D错误.
故选A.
本题解析:
本题难度:一般