微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图装置中盛KOH溶液的部分是一个氢氧燃料电池,对此装置的分析合理的的是
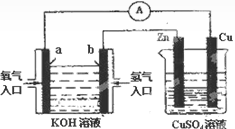
A.该装置中Cu极为正极
B.一段时间后锌片质量减少
C.b极的电极反应式为H2—2e—=2H+
D.一段时间后,硫酸铜溶液的浓度不变
参考答案:D
本题解析:氢氧燃料电池中,通入氢气的b电极为负极,通入氧气的a电极是正极,右侧装置为电解池,与正极相连的Cu电极为阳极,与负极项链的Zn电极为阴极,故A选项错误;阳极反应式为Cu—2e—=Cu2+,阳离子移向阴极,铜离子比氢离子容易得到电子,则阴极反应式为Cu2++2e—=Cu,所以锌片上镀上一层铜,锌片的质量增大,故B选项错误;KOH溶液显碱性,氢离子不能在碱性溶液中大量共存,则负极反应式为H2—2e—+2OH—=2H2O,故C选项错误;由于阴极消耗的铜离子与阳极生成的铜离子的物质的量相等,则硫酸铜溶液的浓度不变,故D选项正确。
本题难度:简单
2、选择题 下列有关钢铁腐蚀与防护的说法正确的是
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起时,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-=Fe3+
参考答案:B
本题解析:A、电解时,阳极被腐蚀,阴极被保护;连接电源正极的电极为阳极,所以将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀,故A错误;
C、钢管中含有铁,和铜形成原电池,加速钢管的腐蚀,故C错误;
D、析氢腐蚀和吸氧腐蚀,负极上铁失电子发生氧化反应,所以负极均是Fe发生氧化反应Fe-2e-=Fe2+,故D错误。
故选B。
点评:本题考查了金属的腐蚀与防护,难度不大,会运用化学知识解决生产、生活问题,学以致用。
本题难度:简单
3、填空题 如图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)______.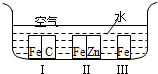
参考答案:铁处于Ⅰ的环境中做原电池的负极,腐蚀速率较快,铁处于Ⅱ的环境中做原电池的正极,被保护,腐蚀速率很慢,铁处于Ⅲ的环境中的金属铁发生吸氧腐蚀,速度较慢.
故答案为:Ⅰ>Ⅲ>Ⅱ.
本题解析:
本题难度:一般
4、填空题 (8分)炒过菜的铁锅未及时洗净,在空气中不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是?腐蚀(填“析氢"或“吸氧” )
(2)写出铁锅腐蚀时负极的电极反应式:?
(3)写出铁锅在中性条件下正极的电极反应式?
(4)写出电化学反应的总方程式?
参考答案:(8分) (1)吸氧(2分)? (2)Fe? -2e-=Fe2+(2分)
(3)2H2O+O2+4e-=40H-(2分)? (4)2Fe+2H2O+O2==2Fe(OH)2(2分)
本题解析:(1)铁锅的锈蚀是吸氧腐蚀
(2)铁锅腐蚀时负极的电极反应式:Fe -2e-=Fe2+
(3)铁锅在中性条件下正极的电极反应式:2H2O+O2+4e-=40H—
(4)电化学反应的总方程式:2Fe+2H2O+O2=2Fe(OH)2
本题难度:简单
5、填空题 (1)金属腐蚀一般可分为化学腐蚀和?腐蚀。
(2)炒过菜的铁锅未及时洗净容易发生腐蚀。
①若铁锅内残液呈弱酸性,则腐蚀属于?(填“吸氧”或“析氢”,下同)腐蚀;若残液中主要含有NaCl,腐蚀应属于?腐蚀。
②吸氧腐蚀中,负极的电极反应式为 ?。
铁锈中铁的化合价为?。
参考答案:(1)电化学(1分)
(2)①析氢 (1分);吸氧 (1分)
② Fe- 2e-=Fe2+?(2分)? +3 (1分)
本题解析:
试题解析:(1)金属腐蚀一般分为化学腐蚀和电化学腐蚀。
(2)①在酸性条件下会发生析氢腐蚀,在中性或碱性条件下会发生吸氧腐蚀,
②吸氧腐蚀中,负极发生氧化反应,铁失去电子而成为Fe2+,与正极产生的OH-结合生成Fe(OH)2,在空气中继续被氧化最终生成Fe2O3,所以铁锈中铁的化合价为+3价。
本题难度:简单