微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 取一定量的Na2CO3、NaHCO3和Na2SO4的混合物与250mL1moL/L过量盐酸反应,生成2.016LCO2(标准状态)。然后加入500mL0.1moL/LBa(OH)2溶液,得到沉淀的质量为2.33克。溶液中过量的碱用10mL1moL/L盐酸恰好完全中和。计算混合物中各物质的质量。
参考答案:m(Na2CO3)=7.42g
m(NaHCO3)=1.68g
m(Na2SO4)=1.42g
本题解析:
本题难度:一般
2、选择题 由10克含杂质的CaCO3和足量的盐酸反应,产生了0.1 mol CO2,推断杂质的组成可能是?
[? ]
A. MgCO3和SiO2
B. K2CO3和Na2CO3
C. KHCO3和MgCO3
D. Na2CO3和KHCO3
参考答案:A
本题解析:
本题难度:一般
3、计算题 将等物质的量的两种氧化物溶于100mL硫酸,而后逐滴加入1.00mol·L-1的NaOH溶液。当加入的NaOH的体积V1=650mL时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小。当V3≥750mL时,沉淀量不再改变。
(1)最初加入的50mL NaOH溶液的作用是什么?
(2)计算所用硫酸的浓度。
(3)试判断两种氧化物各是什么,并计算其物质的量。
参考答案:(1)中和过量的硫酸
(2)沉淀量最大时所用OH-的物质的量与100mL强酸中H+的物质的量相等,n(OH-)=1.00mol·L-1×
0.650L=0.650mol,故n(H+)也为0.650mol 硫酸的浓度为3.25mol·L-1
(3)在“考试说明”规定的内容范围内,由题意知,其中一种氧化物为Al2O3,根据Al(OH)3+OH-=AlO2-+2H2O,该反应用去的n(NaOH)=1.00mol·L-1×(0.750-0.650)L=0.100mol
故Al(OH)3为0.100mol,而Al2O3为0.0500mol
根据Al3++3OH-==Al(OH)3 生成Al(OH)3用去0.300mol NaOH。而生成另一种氢氧化物也用去0.300mol
NaOH,且已知两种氧化物的物质的量相等,故另一种氧化物也是三价金属的氧化物,且不溶于过量碱溶液中,可知其为Fe2O3。
Fe2O3的物质的量为0.0500mol。
本题解析:
本题难度:一般
4、选择题 一定条件下,将等体积的NO2和O2的混合气体置于试管中并将该试管倒置于水槽中至液面不再上升时,剩余气体的体积约为原体积的
[? ]
A.1/4
B.3/4
C.1/8
D.3/8
参考答案:D
本题解析:
本题难度:一般
5、选择题 同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3,②NO2,进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度为
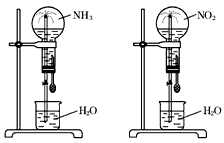
[? ]
A.①>②
B.①<②
C.①=②
D.不能确定
参考答案:C
本题解析:
本题难度:简单