| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《物质的量》高频试题强化练习(2017年最新版)(四)
参考答案:A 本题解析:根据反应后无剩余气体,即全部生成了硝酸,根据反应中电子得失守恒:n(NO)×3+n(NO2)=n(O2)×4来判断即可,则A.NO、NO2、O2的气体体积比为1:2:1,物质的量之比为1:2:1,此时1×3+2≠1×4,故A正确;B.NO、NO2、O2的气体体积比为1:1:1,物质的量之比为1:1:1,此时1×3+1=1×4,故B错误;C.NO、NO2、O2的气体体积比为5:1:4,物质的量之比为5:1:4,此时5×3+1=4×4,故C错误;D.NO、NO2、O2的气体体积比为6:2:5,物质的量之比为6:2:5,此时6×3+2=5×4,故D错误;故选A。 本题难度:一般 2、选择题 下列条件下,两瓶气体所含原子数、分子数一定相等的是 |
参考答案:D
本题解析:A、没有指明同压,同温度、同体积的N2和CO物质的量不一定相等,则分子数和原子数均不一定相等,故A错误;B、同密度、同体积的H2和N2,质量相等,因为H2与N2的摩尔质量不相等,所以因为H2与N2的物质的量不相等,分子数和原子数均不相等,故B错误;C、同温度、同压强的C2H4和C3H6体积大小不知道,则无法比较物质的量,分子数和原子数也无法比较,故C错误;D、N2O和CO2的摩尔质量相同,均为44g/mol,所以同质量N2O和CO2物质的量相同,则分子数和原子数相等,故D正确。
考点:本题考查阿伏加德罗定律及其推论。
本题难度:一般
3、计算题 (6分)直接填写计算结果:
(1)标准状况下3.36 L某气体的质量为8.1 g,则该气体的摩尔质量为 g/mol。
(2)某块光卤石(KCl·MgCl2·6H2O)中含5.3250 g Cl-,则该光卤石的物质的量为 mol。
(3)11.2 g 铁粉与足量的稀硫酸反应生成的氢气在标准状况下的体积为 L。
参考答案:(1)54g/mol;(2)0.05mol;(3)4.48L。
本题解析:(1)3.36 L气体的物质的量是n=V÷Vm=3.36L÷22.4L/mol=0.15mol,由于该气体的质量是8.1 g,根据物质的量与摩尔质量的关系时n=m÷M,则气体的摩尔质量是M=m÷n=8.1 g÷0.15mol=54g/mol;(2)每一mol的光卤石(KCl·MgCl2·6H2O)中含有Cl-的物质的量是3mol,5.3250 g Cl-的物质的量是n(Cl-)="5.3250" g÷35.5g/mol=0.15mol,则该块光卤石的物质的量是n=0.15mol÷3=0.05mol;(3)Fe与硫酸发生反应:Fe+H2SO4=FeSO4+H2↑,由于硫酸足量,所以产生氢气的物质的量由铁决定。n(Fe)= 11.2 g÷56g/mol=0.2mol,所以产生标准状况下的氢气的体积是V=n?Vm=0.2mol×22.4L/mol=4.48L。
考点:考查关于物质的量的有关计算的知识。
本题难度:一般
4、选择题 1.6 g氢氧化钠恰好与40 mL的硫酸完全反应,则硫酸的物质的量浓度为( )[
A.0.1 mol·L-1
B.0.2 mol·L-1
C.0.5 mol·L-1
D.1 mol·L-1
参考答案:C
本题解析:1.6g氢氧化钠是1.6g÷40g/mol=0.04mol,根据方程式2NaOH+H2SO4=Na2SO4+2H2O可知,消耗硫酸是0.2mol,所以硫酸的浓度是0.2mol÷0.04L=0.5mol/L,答案选C。
本题难度:一般
5、计算题 在一定温度下,某饱和氢氧化钠溶液体积为V? mL,溶液密度为d g·cm-3,质量分数为w%,物质的量浓度为c mol·L-1,溶液中含氢氧化钠质量为m g。
(1)用w来表示该温度下氢氧化钠的溶解度(S)为__________。
(2)用m、V表示溶液中溶质的物质的量浓度c为__________。
(3)用w、d表示溶液中溶质的物质的量浓度c为__________。
(4)用c、d表示溶液中溶质的质量分数为__________。
参考答案:(1)S= ×100 g
×100 g
(2)c=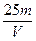 mol·L-1
mol·L-1
(3)c="0.25dw" mol·L-1
(4)w%=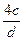 %
%
本题解析:这是一道只给出抽象符号的有关溶解度、质量分数、物质的量浓度的相互换算的问题。解答本题的关键是:在准确把握溶解度、溶液中溶质质量分数、溶液中溶质物质的量浓度的基础上,从未知求问的概念出发,进行概念分析,抓好相关概念的相互联系,便可顺利完成这种用符号表示的相互换算。
(1)S= ×100 g
×100 g
(2)c="1" 000 mL·L-1×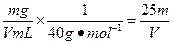 mol·L-1
mol·L-1
(3)c=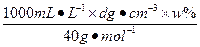 ="0.25dw" mol·L-1
="0.25dw" mol·L-1
w%= ×100%=
×100%=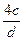 %
%
点评:溶液中溶质质量分数与物质的量浓度相互换算,一定要通过溶液密度这个桥梁,溶液的质量除以溶液密度等于溶液的体积。这个体积的单位是“mL”而不是“L”,忽略了抽象符号的单位,将导致换算结果的错误。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《弱电解质电.. | |