微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将一定质量的铜粉加入到100?mL某浓度的稀硝酸中,充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体448?mL ?(标准状况)。然后向上述混合物中加入足量稀硫酸至不再反应为止,容器剩有铜粉m2g,则(m1-m2)为?
[? ]
A?5.76?g?
B.2.88?g?
C.1.92?g?
D.0?g
参考答案:A
本题解析:
本题难度:一般
2、选择题 铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):下列计算结果正确的是
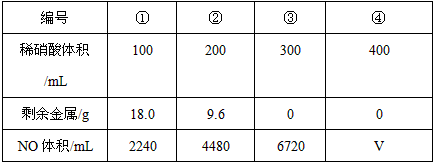
[? ]
A.硝酸的浓度为4mol/L
B.①中溶解了5.6gFe
C.②中溶解了9.6gCu
D.④中V=8960
参考答案:AD
本题解析:
本题难度:一般
3、选择题 分别用等质量的金属钠进行下列实验,其中生成氢气的体积(同温同压)最大的是
[? ]
A.将钠投入到足量水中?
B.将钠用铝箔包好并刺一些小孔,再放入足量水中
C.将钠放入足量稀硫酸中?
D.将钠放入足量氢氧化钠溶液中
参考答案:B
本题解析:
本题难度:一般
4、计算题 在标准状况下进行甲、乙、丙三组实验,三组各取30mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下

(1)甲组实验中,盐酸________(填“过量”“适量”或“不足量”),乙组实验中,盐酸_______(填“过量”“适量”或“不足量”)。参考合适的数据计算出盐酸的物质的量浓度为_______________。
(2)参考合适的数据组合求得的Mg、Al的物质的量之比为_____________________。
(3)在丙组实验之后,向容器中加入1 mol·L-1的氢氧化钠溶液,能使合金中的铝恰好溶解,不形成含铝的沉淀,并使Mg2+刚好沉淀完全,再过滤出不溶固体,求滤液中各溶质的物质的量和所加入氢氧化钠溶液的体积。
参考答案:(1)过量; 不足量; 1mol·L-1?
(2)1∶1?
(3)滤液中溶质为NaCl,NaAlO2?
设丙组中Mg、Al的物质的量均为x。?
则24x+27x=0.459
x=0.009mol?
根据Cl元素守恒:?
n(NaCl)=n(HCl)=1×0.03=0.03mol?
根据Al元素守恒:n(NaAlO2)=n(Al)=0.009mol?
由Na元素守恒:n(NaOH)=n(NaCl)+n(NaAlO2)=0.03+0.009=0.039mol
V(NaOH)=0.039L=39mL
本题解析:
本题难度:一般
5、计算题 实验室用120 mL 10 mol/L的浓盐酸和MnO2共热制取Cl2,生成标准状况下的Cl2 2.24 L,试计算:
(1)被氧化的HCl的物质的量。
(2)参加反应的MnO2的质量。
参考答案:MnO2? +?4HCl(浓) MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
87 g? 4/2 mol?22.4 L
m( MnO2)?n(HCl)? 2. 24 L
(l)n(HCl)=4/2 mol×2.24 L/22.4 L =0.2 mol
(2)m(MnO2)=87g×2.24 L/22.4 L =8.7 g
答:被氧化的HCl的物质的量是0.2 mol,参加反应的MnO2的质量是8.7 g
本题解析:
本题难度:一般