微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关NaHCO3和Na2CO3和的叙述中,正确的是
A.NaHCO3做发酵粉,Na2CO3可以用来制玻璃
B.NaHCO3俗名纯碱,Na2CO3俗名苏打
C.NaHCO3溶液显酸性,Na2CO3溶液显碱性
D.NaHCO3和Na2CO3各1mol分别与过量盐酸充分反应,产生CO2的质量不同
参考答案:A
本题解析:分析:A、依据NaHCO3和Na2CO3 的用途分析判断;
B、根据碳酸氢钠和碳酸钠的俗名来回答;
C、碳酸根离子和碳酸氢根离子均能水解;
D、Na2CO3和NaHCO3分别能与盐酸反应,放出CO2.等物质的量的Na2CO3和NaHCO3分别与过量盐酸反应,放出CO2一样多.
解答:A、NaHCO3做发酵粉,因为碳酸氢钠会产生二氧化碳气体,增加面团内部空隙,Na2CO3可以用来做制玻璃的原料,发生反应SiO2+Na2CO3 Na2SiO3+CO2↑,得到硅酸盐,故A正确;
Na2SiO3+CO2↑,得到硅酸盐,故A正确;
B、NaHCO3俗名小苏打,Na2CO3俗名纯碱,故B错误;
C、NaHCO3溶液显碱性,Na2CO3溶液显碱性,是由于其中的弱酸阴离子水解导致的,故C错误;
D、NaHCO3和Na2CO3都可以与盐酸反应,Na2CO3+2HCl=2NaCl+H2O+CO2↑(盐酸过量),NaHCO3+HCl=NaCl+H2O+CO2↑,等物质的量的Na2CO3和NaHCO3分别与过量盐酸反应,放出CO2质量相等,故D错误.
故选A.
点评:本题考查Na2CO3和NaHCO3性质的异同,题目难度不大,注意把握Na2CO3和NaHCO3性质,注重基础知识的积累.
本题难度:困难
2、选择题 将7.2gCO和H2的混合气体在足量氧气中充分燃烧后的产物立即通入盛有足量Na2O2的反应管,固体的质量增加
A.2.1g
B.3.6g
C.7.2g
D.无法确定
参考答案:C
本题解析:分析:利用差量法,根据化学方程式分析:CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应.
2CO+O2? 2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,
2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,
质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2 2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知,反应后固体增加的质量为氢气质量.
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知,反应后固体增加的质量为氢气质量.
解答:2CO+O2? 2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2
2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2 2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知,反应后固体增加的质量为氢气质量.所以将7.2gCO和H2的混合气体在足量氧气中充分燃烧后的产物立即通入盛有足量Na2O2的反应管,固体质量增重为7.2gCO和H2的混合气体的质量;
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知,反应后固体增加的质量为氢气质量.所以将7.2gCO和H2的混合气体在足量氧气中充分燃烧后的产物立即通入盛有足量Na2O2的反应管,固体质量增重为7.2gCO和H2的混合气体的质量;
故选C.
点评:本题考查混合物的计算,注意从CO2、H2O与Na2O2生成固体质量的变化分析规律,这是解答该题的关键.
本题难度:一般
3、选择题 类似于Fe3O4,铅也有化学式为Pb3O4的氧化物。以下说法正确的是
①Pb3O4里Pb的化合价为+2和+3? ②Pb3O4里Pb的化合价为+2和+4?
③Pb3O4的化学式还可以表示为PbO·Pb2O3? ④Pb3O4的化学式还可以表示为2PbO·PbO2
A.①③
B.②③
C.①④
D.②④
参考答案:D
本题解析:Pb是第ⅣA族元素,主要化合价为+2、+4,故Pb3O4可表示为2PbO·PbO2。
本题难度:简单
4、选择题 下列物质转化在给定条件下能实现的是
①FeS2 SO3
SO3 H2SO4
H2SO4
②Al2O3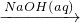 NaAlO2(aq)
NaAlO2(aq) Al(OH)3
Al(OH)3
③NaCl(aq)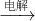 Na
Na ?Na2O2
?Na2O2
④Fe FeSO4(aq)
FeSO4(aq)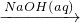 Fe(OH)2
Fe(OH)2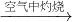 Fe2O3
Fe2O3
⑤海水 母液
母液 粗溴
粗溴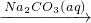
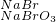
 Br2.
Br2.
A.①③⑤
B.②③④
C.②④⑤
D.①④⑤
参考答案:C
本题解析:分析:①FeS2生成SO2;
②NaAlO2与弱酸反应生成Al(OH)3;
③应电解熔融的NaCl;
④Fe(OH)2可被氧化为Fe(OH)3;
⑤NaBr与NaBrO3在酸性条件下发生氧化还原反应生成Br2.
解答:①FeS2生成SO2,应在催化剂条件下继续与氧气反应可生成SO3,故①错误;
②Al(OH)3具有两性,与强酸反应,NaAlO2与弱酸反应生成Al(OH)3,故②正确;
③电解氯化钠溶液生成氢氧化钠、氢气和氯气,应电解熔融的NaCl,故③错误;
④Fe(OH)2可被氧化为Fe(OH)3,加热分解可生成Fe2O3,故④正确;
⑤NaBr与NaBrO3在酸性条件下发生氧化还原反应生成Br2,故⑤正确.
故选C.
点评:本题较为综合,涉及元素化合物知识的考查,侧重于基础知识,注意把握相关物质的性质,学习中注意积累,题目难度不大.
本题难度:一般
5、选择题 下列物质暴露在空气中不易变质的是
A.氯化钠
B.过氧化钠
C.氢氧化钠
D.漂白粉
参考答案:A
本题解析:分析:会变质即发生了化学变化,也就是与空气中的成分发生了化学反应.利用这一知识分析解决即可.
解答:A、氯化钠性质稳定,在空气中不易变质,故A正确;
B、过氧化钠在空气中会与水蒸气、二氧化碳等反应生成氢氧化钠、碳酸钠易变质,故B错误;
C、氢氧化钠在空气中会与二氧化碳反应生成碳酸钠而变质,故C错误;
D、漂白粉回合空气中的空气中的水以及二氧化碳反应生成碳酸钙和次氯酸而变质,故D错误.
故选A.
点评:此题是对一些常见物质性质的考查,解决的关键是能对几种物质在空气中发生的化学变化有所了解,属基础性知识考查题.
本题难度:一般