微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 已知D、M、H是常见的非金属单质,其中M是无色气体,H是有色气体,J是一种金属单质(其同族的某种元素是形成化合物种类最多的元素),A、C是金属氧化物,C和J均是某种常见电池的电极材料,J元素的+2价化合物比+4价化合物稳定,B与C反应时,每生成1molH同时消耗4molB和1molC,K只知含有CO?或CO2中的一种或两种.它们关系如图:

(1)写出下列物质的化学式:A______?D______
(2)写出下列反应的化学方程式:
②______
⑤______
(3)由金属氧化物A和C得到其相应的金属,在冶金工业上一般可用______方法(填序号)
①热分解法?②热还原法?③电解法
其中从A得到其相应金属也可用铝热法,若反应中1molA参加反应,转移电子的物质的量为______
(4)用C、J作电极,与硫酸构成如图所示电池,正极的电极反应为______当反应转移1mol电子时,负极质量增加______g.

参考答案:H是有色气体判断为Cl2,J是一种金属单质(其同族的某种元素是形成化合物种类最多的元素)推断为Pb,J+H=I,可以判断I为PbCl2,A、C是金属氧化物,C和J均是某种常见电池的电极材料,J元素的+2价化合物比+4价化合物稳定,C为PbO2,K只知含有CO?或CO2中的一种或两种,结合C+D=J+K 可知此反应为是碳和PbO2的反应,判断为D为C;F+G=红褐色液体证明生成的是氢氧化铁胶体,E+H=F,A+B=E+F+G 推断E为FeCl2;F为FeCl3;G为H2O;B为HCl;A为Fe3O4;依据G+H=B+L可知L为HClO,M为O2;B与C反应时,每生成1molH同时消耗4molB和1molC,判断反应PbO2+4HCl=2H2O+Cl2↑+PbCl2;推断出的物质为:A、Fe3O4 ;B、HCl;C、PbO2 ;D、C;E、FeCl2;F、FeCl3;G、H2O;H、Cl2;L、HClO;J、Pb;K、CO、CO2;I、PbCl2;M、O2;
(1)A物质的化学式为:Fe3O4;D的化学式为C,故答案为:Fe3O4;C;
(2)②是B与C反应时,每生成1molH同时消耗4molB和1molC,化学方程式为:PbO2+4HCl(浓)═PbCl2+Cl2↑+2H2O;⑤是次氯酸见光分解的反应,化学方程式为:2HClO═2HCl+O2↑,
故答案为:PbO2+4HCl(浓)═PbCl2+Cl2↑+2H2O;2HClO═2HCl+O2↑;
(3)由金属氧化物A为Fe3O4和C为PbO2 得到其相应的金属为Fe、Pb,依据金属活动顺序表中 金属冶炼的方法分析判断,在冶金工业上一般可用热还原法:故选②;?其中从A得到其相应金属也可用铝热法,发生的反应为3Fe3O4+8Al?高温?.?9Fe+4Al2O3;若反应中1molA参加反应,转移电子的物质的量为8mol,
故答案为:②;8mol;
(4)用C、J作电极,与硫酸构成如图所示电池是铅蓄电池,正极为PbO2;电极反应为:PbO2+2e-+4H++SO42-═PbSO4+2H2O;负极为Pb;电极反应为:Pb+SO42--2e-=PbSO4;?当反应转移1mol电子时,反应0.5molPb质量=0.5mol×207.2g/mol=103.6g,生成0.5molPbSO4质量=0.5mol×303.2g/mol=151.6g;负极质量增加=151.6g-103.6g=48g,
故答案为:PbO2+2e-+4H++SO42-═PbSO4+2H2O;48.
本题解析:
本题难度:一般
2、填空题 A、B、C、D、E、F六种物质,一定条件下有如下图所示的转化关系(所有的反应物和生成物均已给出):
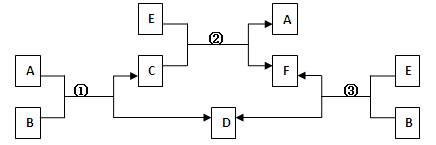
(1)若①、②、③均为水溶液中的置换反应,且A、D、E是常见的卤素单质,B、C、F为化合物。则A、D、E的氧化性由强到弱的顺序为?(用字母表示),其中A的化学式为?(用元素符号表示)。
(2)若B是一种淡黄色固体,绿色植物的呼吸作用和光合作用可实现自然界中D和E的循环,则F的化学式为?;反应①的离子方程式是?。
(3)若B是水,C是一种有磁性的化合物,E是一种无色、无味的有毒气体,则反应①的化学方程式是?;反应③是某些氮肥厂获得合成氨原料D的一个重要反应,假设反应后的气体中只有F和D,从综合经济效益的角度考虑,简述如何从反应后的混合物中分离出D。?。
参考答案:(1)E A D或E>A>D (3分。用元素符号表示不给分), Br2(1分。Br不给分)。
(2)Na2CO3(2分);
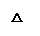 ? 2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑(2分。没配平给1分,化学式写错不给分。)
? 2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑(2分。没配平给1分,化学式写错不给分。)
(3)3Fe + 4H2O?= Fe3O4 + 4H2↑(2分。没配平给1分,无△或高温条件不给分)
将混合气体通入氨水中(2分。只要是用氨水吸收CO2即给2分。)
本题解析:略
本题难度:一般
3、填空题 A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2 O已略去)。请填空:

(1)若D是生产、生活中用量最大、用途最广的金属单质,A是黄绿色气体,请写出C的化学式?。
(2)若A是一种碱性气体,常用作制冷剂,B和D为空气的主要成分,则反应②的化学方程式为________________________________________。
(3)若D为酸或酸性气体,则A、C可以是???(请按顺序写出任意一组符合要求的物质的化学式)
(4)若B为淡黄色晶体,则反应③的化学方程式为____________________________________。
参考答案:(8分) (1) FeCl2? (2)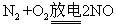 ? (3) NaOH、NaHCO3或Fe、
? (3) NaOH、NaHCO3或Fe、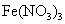 或
或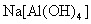 、
、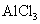 或
或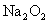 、
、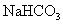 等(其他合理答案均给分) (4)2H2S +SO2?=== 3S↓+2H2O
等(其他合理答案均给分) (4)2H2S +SO2?=== 3S↓+2H2O
本题解析:(1)若D是生产、生活中用量最大、用途最广的金属单质,则D是铁。A是黄绿色气体,则A是氯气,所以B是氯化铁。氯化铁和铁反应生成氯化亚铁,即C的化学式FeCl2。
(2)若A是一种碱性气体,常用作制冷剂,则A是氨气。B和D为空气的主要成分,所以D是氧气,B是氮气,C是NO,则反应②的化学方程式为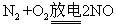 。
。
(3)若D为酸或酸性气体,则根据常见物质的性质和有关转化可知,A、C可以是NaOH、NaHCO3或Fe、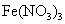 或
或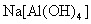 、
、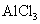 或
或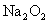 、
、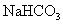 等。
等。
(4)若B为淡黄色晶体,则B是单质S,而不可能是过氧化钠,则A是H2S,D是氧气,C是SO2,所以反应③的化学方程式为2H2S +SO2?=== 3S↓+2H2O。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固和训练,有助于培养学生严谨的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是熟练记住常见元素及其化合物的转化,准确判断出突破点,并能结合题意灵活运用即可。
本题难度:一般
4、推断题 下图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下气态化合物,C为常温下液态化合物,图中有部分生成物未标出。
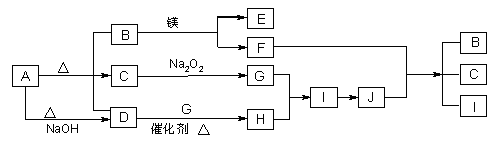
请填写以下空白:
(1)A的化学式?。
(2)写出下列反应的化学方程式:
A→B+C+D _______________________________D→ H?___________________。
I→J? _______________________________________________。
(3)写出在溶液中A+NaOH→D完全反应的离子方程式:______________________________________。
参考答案:(1)NH4HCO3
(2) NH4HCO3 NH3↑+CO2↑+H2O;4NH3+5O2
NH3↑+CO2↑+H2O;4NH3+5O2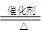 4NO + 6H2O ;3NO2+ H2O=2HNO3+NO
4NO + 6H2O ;3NO2+ H2O=2HNO3+NO
(3)NH4+ + HCO3- +2OH- NH3↑ +CO32- +2H2O
NH3↑ +CO32- +2H2O
本题解析:A受热能分解,分解得到等物质的量的B、C、D,且A与碱反应生成气体D,B、D为常温下气态化合物,C为常温下液态化合物,因此C为水,则A为NH4HCO3。B能与镁反应,则B为CO2,E为MgO,F为C,结合D为NH3,水与过氧化钠反应生成G,G为O2,D与G反应生成H,H为NO,I为NO2,J为HNO3,再结合F与J反应生成B、C、I,符合上述转化。
点评:该题是中等难度的试题,侧重对学生答题能力的培养。利用物质的转化推断出各物质是解答本题的关键,C及A为解答本题的突破口。该类试题需要明确的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
5、填空题 (14分)X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,相关信息如下表:
元素
| 相关信息
|
X
| X原子核外最外层电子数是次外层的2倍
|
Y
| Y的气态氢化物的水溶液显弱碱性
|
Z
| Z是地壳中含量最多的金属元素
|
W
| 常温常压下,W的单质是淡黄色固体
|
Q
| ……
|
根据上述信息回答下列问题:
 (1)元素Q在元素周期表中的位置______________________________.
(1)元素Q在元素周期表中的位置______________________________.
(2)Y的最简单气态氢化物甲的水溶液可与H2O2发生反应,其产物不污染环境,化学方程式为______________________________________.(用元素符号表示,下同)
(3)X和氢元素组成的化合物分子有6个原子,其结构式为?.
(4)已知:X(s)+O2(g) =XO2(g)?△H = -393.5kJ·mol-1
2X(s)+O2(g) ="2XO(g)?" △H = -221.0kJ·mol-1
则XO的燃烧热的热化学方程式__________________________________________________.
(5)元素Y与氢元素形成的五核阳离子乙,向含乙和Z的阳离子的混合溶液中加入固体Na2O2,加入Na2O2的物质的量与产生沉淀有如图所示关系:

写出有关反应离子方程式:(每段只用一个离子方程式表示)
o—a段?
a—b段?.
参考答案:(共14分)
(1)第三周期第ⅦA族?(2分)
(2) 2NH3+3H2O2=N2+6H20?(3分)
(3)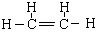 (写CH2=CH2不给分)(2分)
(写CH2=CH2不给分)(2分)
(4) CO(g)+ ?
? O2(g)=CO2(g)?△H=-283.0kJ·mol-1?(3分)
O2(g)=CO2(g)?△H=-283.0kJ·mol-1?(3分)
(5)? 6Na2O2+4Al3++6H2O=4Al(OH)3↓+3O2↑+12Na+?(2分)
2Na2O2+4NH4+=4NH3↑+O2↑+4Na++2H2O?(2分)
本题解析:略
本题难度:一般