微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各反应中,水作还原剂的是
A.2H2+O22H2O
B.2F2+2H2O═4HF+O2
C.SO3+H2O═H2SO4
D.2Na+2H2O═2NaOH+H2↑
参考答案:B
本题解析:分析:若水作还原剂,则水中O元素的化合价升高,以此来解答.
解答:A.2H2+O2 2H2O中,水为生成物,则水不是还原剂,故A错误;
2H2O中,水为生成物,则水不是还原剂,故A错误;
B.2F2+2H2O═4HF+O2中,水中O元素的化合价升高,则水作还原剂,故B正确;
C.SO3+H2O═H2SO4中,各元素的化合价没有变化,则不属于氧化还原反应,水为反应物,故C错误;
D.2Na+2H2O═2NaOH+H2↑中,水中H元素的化合价降低,则水为氧化剂,故D错误;
故选B.
点评:本题考查氧化还原反应,明确反应中元素的化合价变化及还原剂的判断即可解答,题目较简单.
本题难度:一般
2、填空题 (12分)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
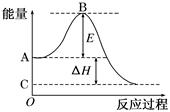
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。请回答下列问题:
⑴图中A点表示: _____;C点表示: (填“反应物的总能量”“生成物的总能量”)
⑵E的大小对该反应的反应热________(填“有”或“无”)影响。
⑶图中ΔH=________kJ/mol。
参考答案:(1)反应物的总能量;生成物的总能量(2)无 (3)-198
本题解析:(1)本小题考查反应物总能量高于生成物总能量为放热反应,可得到A和C所表示的意义。
(2)E为活化能与反应热无关,但是用催化剂可以降低活化能。
(3)图中表示的是2molSO2的反应,因此△H=-99×2KJ·mol-1=-198kJ/mol
本题难度:一般
3、选择题 下列事实中,能够证明HCl是共价化合物的是
A.HCl易溶于水
B.液态的HCl不导电
C.HCl不易分解
D.HCl溶于水能电离,呈酸性
参考答案:B
本题解析:共价化合物的构成微粒不带电,则液态不导电。但离子化合物的构成微粒带电,其液态能导电,以此来证明氯化氢是共价化合物。
A、不能利用溶解性判断是否为共价化合物,如NaCl也易溶于水,但属于离子化合物,故A错误;
B、因共价化合物的构成微粒不带电,离子化合物的构成微粒带电,则可利用液态氯化氢不导电来证明氯化氢是共价化合物,故B正确;
C、不能利用分解来判断是否为共价化合物,如NaCl受热也不易分解,但属于离子化合物,故C错误;
D、氯化氢溶于水,溶液显酸性,不能作为判断是否为共价化合物的依据,例如硫酸氢钠溶于水也显酸性,而硫酸氢钠是离子化合物,故D错误,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。侧重对学生能力的培养和解题方法的指导与训练。有利于培养学生的逻辑思维能力和逆向思维能力。明确共价化合物的构成微粒是解答本题的关键。
本题难度:简单
4、填空题 下表为元素周期表的一部分:
Ⅰ.请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)写出元素②的离子结构示意图______________。
(2)②、③、⑤的离子半径由大到小的顺序为_________________________。
(3)元素④与⑥形成化合物的电子式是_________________________。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图所示的变化,其中A是一种淡黄色固体。请回答:
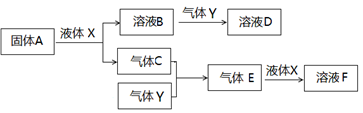
(4)写出固体A与液体X反应的离子方程式 。
(5)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1:1且恰好完全反应时,所得溶液D。已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为 。
(6)在500℃,101kPa时,气体C与气体Y反应生成0.2mol气体E时,放出akJ热量,写出该条件下反应的热化学方程式 。
(7)若气体C与Y在恒容绝热的条件下反应,下列说法能判断达到平衡状态的是 。
A.温度不变 B.气体总压强不变 C.混合气体的密度不变 D.混合气体的平均分子量不变
参考答案:Ⅰ.(1)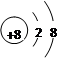 (1分) (2)S2->O2-> Na+(2分) (3)SiCl4
(1分) (2)S2->O2-> Na+(2分) (3)SiCl4
Ⅱ.(4)2Na2O2 +2H2O=4Na+ + 4OH
本题解析:
本题难度:困难
5、选择题 已知充分燃烧a g乙炔(C2H2)气体时生成2 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧热的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)=4C来源:91考试网 91Exam.orgO2(g)+2H2O(l) ΔH=-2b kJ / mol
B.C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) ΔH=-b kJ / mol
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-4b kJ / mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=b kJ / mol