|
高中化学知识点讲解《原电池原理》考点特训(2017年冲刺版)(十)
2017-09-23 22:36:48
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
A.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)
B.脱氧过程中铁作原电池正极,电极反应为:Fe-2e
|
参考答案:
本题解析:
本题难度:一般
2、选择题 下列实验能达到预期目的是( )
A.为减小配制溶液的误差,容量瓶必须洗净并烘干后才能使用
B.向溶液中滴入盐酸有无色无味气体产生,则证明溶液中有CO32-
C.含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2,充分反应后过滤可除去Ca(OH)2
D.把纯净的铁和锌用导线连接一起插入到经过酸化的3%的NaCl溶液中,往铁电极区滴入2滴KSCN,有红色出现
参考答案:A.配制溶液,还需要定容,则容量瓶不需要烘干,容量瓶中有水对实验无影响,但必须洗净,故A错误;
B.因CO32-、HCO3-均能盐酸反应生成二氧化碳,则向溶液中滴入盐酸有无色无味气体产生,则不能证明溶液中有CO32-,故B错误;
C.因氢氧化镁的溶解度比氢氧化钙的溶解度小,则含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2,发生Ca(OH)2+Mg2+?Mg(OH)2+Ca2+,则充分反应后过滤可除去Ca(OH)2,故C正确;
D.纯净的铁和锌用导线连接一起插入到经过酸化的3%的NaCl溶液中构成原电池,Zn比Fe活泼,则Zn为负极,发生Zn+2H+=Zn2++H2↑,所以往铁电极区滴入2滴KSCN,不会有红色出现,故D错误;
故选C.
本题解析:
本题难度:简单
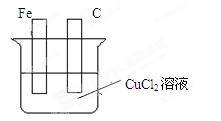
3、填空题 Ⅰ.在下图的装置中,属于原电池的是??。

Ⅱ.(1)如图所示,烧杯中为CuCl2溶液,在图中画出必要的连线或装置,使连接后的装置为原电池。电极反应方程式:
铁板:?;碳棒:?。
(2)铜片、锌片连接后浸入稀硫酸中构成原电池,当导线上通过3.01×1022个电子时,锌片质量减少________g 。铜片表面析出氢气_________L(标准状况)。
参考答案:Ⅰ.D、F、G?Ⅱ.(1)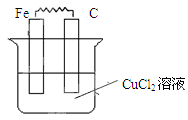 Fe-2e-=Fe2+? Cu2++2e-=Cu Fe-2e-=Fe2+? Cu2++2e-=Cu
(2)1.625g? 0.56L
本题解析:Ⅰ.原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,据此可知:
A、该装置只有一个电极材料,所以不能形成原电池;
B、该装置只有一个电极材料,且石墨和电解质溶液不能自发的进行氧化还原反应,所以不能形成原电池;
C、两电极材料相同,所以不能形成原电池,故错误;
D、该装置符合原电池的构成条件,所以能形成原电池,故正确;
E、酒精不是电解质,铁和酒精不能自发的进行氧化还原反应,所以不能形成原电池;
F、该装置符合原电池的构成条件,所以能形成原电池,故正确;
G、该装置符合原电池的构成条件,所以能形成原电池,故正确;
H、该装置两电极间不能构成闭合回路,所以不能形成原电池,所以答案选D、F、G
Ⅱ.(1)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。铁是活泼的金属,所以铁是负极,碳棒是正极,溶液中的铜离子再正极得到电子,发生还原反应,电极反应式分别是Fe-2e-=Fe2+、Cu2++2e-=Cu。
(2)铜片、锌片连接后浸入稀硫酸中构成原电池,其中锌是负极,铜是正极,电极反应式分别是Zn-2e-=Zn2+、2H++2e-=H2↑。3.01×1022个电子的物质的量是3.01×1022÷6.02×1023/mol=0.05mol,所以锌片质量减少0.025mol×65g/mol=1.625g,铜片表面析出氢气的体积(标准状况下)是0.025mol×22.4L/mol=0.56L。
点评:该题是高考中的常见考点,侧重对学生基础知识的巩固和训练。有利于培养学生的逻辑推理能力和规范答题能力。明确原电池的工作原理、构成条件是答题的关键,注意相关知识的积累和总结。
本题难度:一般
4、选择题 2012年6月16日18时37分24秒,神舟九号成功发射。飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池。该燃料电池可同时供应电和水蒸气,其所用燃料为氢气,电解质为熔融的碳酸钾。已知该燃料电池的总反应为2H2+O2=2H2O,负极反应为H2+CO32—-2e-=CO2↑+H2O,则下列推断正确的是( )。
A.电池工作时,CO32—向负极移动
B.电池放电时,电子经外电路由通氧气的正极流向通氢气的负极
C.正极的电极反应为4OH--2e-=O2↑+2H2O
D.通氧气的电极为正极,发生氧化反应
参考答案:A
本题解析:原电池放电时,电子由负极经外电路流向正极,B错误;正极反应为O2+4e-+2H2O=4OH-,C错误;通氧气一极为正极,发生还原反应,D错误。
本题难度:一般
5、选择题 某装置如图所示,下列有关叙述正确的是?(?)
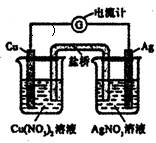
A.该装置为电解池
B.用铜导线代替盐桥,该装置依然能正常工作
C.该装置中总反应为;Cu+2Ag+=Cu2++2Ag
D.Ag一极的反应为:2H++2e一=H2↑
参考答案:C
本题解析:略
本题难度:简单
|