微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 配制一定体积一定物质的量浓度的溶液时,下列情况对实验结果产生偏低影响的是( )
A.容量瓶中原有少量蒸馏水
B.溶解后所用烧杯用蒸馏水洗涤
C.定容时观察液面仰视
D.定容时观察液面俯视
参考答案:A.用于定容时还需要加入蒸馏水,所以容量瓶中原有少量蒸馏水不影响配制结果,故A错误;
B.配制过程中,为了减小误差,溶解后所用烧杯必须蒸馏水洗涤,洗涤液转移到容量瓶中,该操作合理,对配制结果没有影响,故B错误;
C.定容时观察液面仰视,加入的蒸馏水位于容量瓶刻度线上方,导致配制的溶液体积偏大,溶液浓度偏小,故C正确;
D.定容时观察液面俯视,加入的蒸馏水位于刻度线下方,配制的溶液体积偏小,配制的溶液浓度偏高,故D错误;
故选C.
本题解析:
本题难度:简单
2、选择题 用98%的浓H2SO4(密度1.84g/cm3)配制1:4(一体积浓硫酸和四体积水混合)的稀硫酸(密度1.225g/cm3),若用a表示所得硫酸溶液物质的量浓度,用b%表示其溶质质量分数,则下列各式中正确的是
A.
B.
C.
D.
参考答案:AD
本题解析:分析:A、令浓硫酸体积为1mL,则水的体积为4mL,计算稀硫酸的质量,稀硫酸中溶质硫酸为1mL浓硫酸含有的硫酸,再根据质量分数定义计算;
B、稀硫酸体积不等于浓硫酸与水的体积之和;
C、稀硫酸体积不等于浓硫酸与水的体积之和;
D、令浓硫酸体积为1L,则水的体积为4L,计算稀硫酸的质量,进而计算稀硫酸体积,稀硫酸中溶质硫酸为1L浓硫酸含有的硫酸,再根据物质的量浓度定义计算.
解答:A、令浓硫酸体积为1mL,则水的体积为m4L,则稀硫酸的质量为1ml×1.84g/cm3+4ml×1g/ml=(1.84+4)g
溶质硫酸的质量为1ml×1.84g/cm3×98%=1×1.84×98%g,所以稀硫酸的质量分数b%=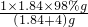 ×100%=
×100%= ×100%,故A正确;
×100%,故A正确;
B、稀硫酸体积不等于浓硫酸与水的体积之和,故B错误;
C、稀硫酸体积不等于浓硫酸与水的体积之和,故C错误;
D、令浓硫酸体积为1L,则水的体积为4L,则稀硫酸的质量为1000ml×1.84g/cm3+4000ml×1g/ml=1000×(1.84+4)g,所以稀硫酸的体积为 =
=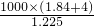 ml=
ml=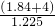 L,所以稀硫酸的物质的量浓度a=
L,所以稀硫酸的物质的量浓度a=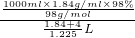 =
=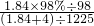 mol/L,故D正确.
mol/L,故D正确.
故选AD.
点评:本题考查溶液的稀释计算,学生应把握溶液稀释前后溶质的质量不变,稀硫酸体积不等于浓硫酸与水的体积之和.
本题难度:简单
3、简答题 (1)0.5mol?H2O的质量为______,其中共含有______个原子.
(2)质量都是50g的?HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是______(填分子式,下同),在相同温度和相同压强条件下,体积最大的是______.
(3)在______mL?0.2mol/L?NaOH溶液中含1g溶质;配制50mL?0.2mol/L?CuSO4溶液,需要CuSO4?5H2O______g.
参考答案:(1)m(H2O)=0.5mol×18g/mol=9g,共含有原子数为:N=3×0.5×NA=9.01×1023,故答案为:9g;9.01×1023;
(2)已知:M(HCl)=36.5g/mol,M(NH3)=17g/mol,M(CO2)=44g/mol,M(O2)=32g/mol,
由n=mM=NNA=VVm可知,相同质量时,摩尔质量越大,气体的物质的量越小,体积越小,则
含有分子数目最少的是CO2,在相同温度和相同压强条件下,体积最大的是NH3,
故答案为:CO2;NH3;
(3)n(NaOH)=1g40g/mol=0.025mol,
V×0.2mol/L=0.025mol,
V=0.125L,即125ml,
n(?CuSO4)=0.05L×0.2mol/L=0.01mol,
m(CuSO4?5H2O )=0.01mol×250g/mol=2.5g,
故答案为:125;2.5.
本题解析:
本题难度:一般
4、简答题 甲乙两人分别用不同的方法配制100ml?3.6mol/L的稀硫酸.
(1)甲:量取20ml?18mol/L浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100ml?容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀.
①实验所用的玻璃仪器除烧杯和容量瓶外,还有______;
②将溶液转移到容量瓶中的正确操作是______;
③定容的正确操作是______.
(2)乙:用100ml?量筒量取20ml?浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100ml?刻度线,再搅拌均匀.
你认为此法是否正确?若不正确,指出其中错误之处______.
参考答案:(1)①操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管),在烧杯中稀释,用玻璃棒搅拌,冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,
故需要的仪器有:烧杯、筒量、玻璃棒、100mL容量瓶、胶头滴管,
故实验所用的玻璃仪器除烧杯和容量瓶外,还有:玻璃棒、胶头滴管、量筒,
故答案为:玻璃棒、胶头滴管、量筒;
②将溶液转移到容量瓶中的作为:将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地倒入容量瓶中,
故答案为:将玻璃棒插入容量瓶刻度线以下,使溶液沿玻璃棒慢慢地倒入容量瓶中;
③定容的操作是:加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切,
故答案为:加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切;
(2)不能用量筒配制溶液,不能将水加入到浓硫酸中,故该做法不正确,
故答案为:不正确,不能用量筒配制溶液,不能将水加入到浓硫酸中.
本题解析:
本题难度:一般
5、选择题 下列溶液中Cl-浓度最小的是( )
A.30mL1.5mol/LMgCl2溶液
B.40mL2.5mol/LNaCl溶液
C.15mL5mol/LKCl溶液
D.25mL1mol/LAlCl3溶液
参考答案:A、30mL1.5mol/LMgCl2溶液中c(Cl-)=1.5mol/L×2=3mol/L;
B、40mL2.5mol/LNaCl溶液中c(Cl-)=2.5mol/L×1=2.5mol/L;
C、15mL5mol/LKCl溶液中c(Cl-)=5mol/L×1=5mol/L;
D、25mL1mol/LAlCl3溶液中c(Cl-)=1mol/L×3=3mol/L;
故40mL2.5mol/LNaCl溶液中Cl-浓度最小,故选B.
本题解析:
本题难度:简单