微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知在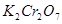 的溶液中存在着如下平衡:
的溶液中存在着如下平衡:

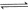
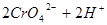
(橙色)?(黄色)
加入下列物质能使溶液变为橙色的是
A.氨水
B.硫酸
C.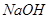
D.水
参考答案:B
本题解析:考查外界条件对平衡的影响。能使溶液变为橙色,则应该使平衡向逆反应方向移动。选项ACD都是使平衡向正反应方向移动的,增大氢离子浓度,平衡向逆反应方向移动,所以溶液变为橙色,答案选B。
本题难度:简单
2、选择题 下列说法正确的是
A.增大压强,活化分子百分数增大,反应速率一定增大
B.升高温度,反应物分子总数增加,活化分子百分数不变,反应速率一定增大
C.加入反应物,使活化分子百分数增大,反应速率增大
D.使用催化剂可降低反应的活化能,增大活化分子百分数,增大反应速率
参考答案:D
本题解析:
本题主要考查:用有效碰撞理论解释化学反应速率改变的微观因素。学生解决问题时要理清:活化分子个数,活化分子百分数,活化能等概念。
A:错在没有理解压强作用的前提条件是对于有气体物质的化学反应。
B:错在没有理解:升高温度是提高了反应物分子的能量,活化能不变,活化分子个数增加,活化分子百分数相应增大。
C:错在没有理解:其它条件不变时,加入反应物,反应物分子总个数和活化分子个数按相同倍数增加,活化分子百分个数不变。
D:正确。
本题难度:简单
3、实验题 (10分)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号
| 反应物
| 催化剂
|
①
| 10mL2% H2O2溶液
| 无
|
②
| 10mL5% H2O2溶液
| 无
|
③
| 10mL5% H2O2溶液
| 1mL0.1mol·L-1FeCl3溶液
|
④
| 10mL5% H2O2溶液+少量HCl溶液
| 1mL0.1mol·L-1FeCl3溶液
|
⑤
| 10mL5% H2O2溶液+少量NaOH溶液
| 1mL0.1mol·L-1FeCl3溶液
|
(1)催化剂能加快化学反应速率的原因是_____________________________________。
(2)实验①和②的目的是____________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是____________________。
(3)写出实验③的化学反应方程式 。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。


分析上图能够得出的实验结论是______________________________________。
参考答案:(1)降低了活化能(2分)?
(2)探究浓度对反应速率的影响 (2分)
向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)(2分)
(3)2H2O2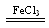 O2↑+2H2O(2分)
O2↑+2H2O(2分)
(4)碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率 (2分)
本题解析:(1)催化剂能加快反应速率的原因是能降低反应的活化能。(2)实验①和②,不同的是浓度,所以探究的是浓度对反应速率的影响。由于长时间没有观察到明星现象,说明反应速率很小,可以使用同种同量的催化剂,或同时加热,即将试管放入同一热水浴中。(3)③是过氧化氢在氯化铁做催化剂条件下的反应,故反应写成:2H2O2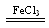 O2↑+2H2O。(4)三个反应中,⑤速率最快,④最慢,说明反应在碱性环境中能增大反应速率,酸性环境能减慢反应速率。
O2↑+2H2O。(4)三个反应中,⑤速率最快,④最慢,说明反应在碱性环境中能增大反应速率,酸性环境能减慢反应速率。
考点:反应速率的影响因素。
本题难度:困难
4、选择题 一定量的稀盐酸跟过量锌粉反应时,为了减缓反应速率又不影响生成H2的总量,可采取的措施是
[? ]
A.加入少量稀NaOH溶液?
B.加入少量CH3COONa固体
C.加入少量Na2SO4固体?
D.加入少量Na2CO3浓溶液
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列措施不能够使化学反应速率加快的是( )
A.升高温度
B.降低温度
C.使用催化剂
D.增大固体反应物面积
参考答案:A.升高温度可以使分子运动速率加快,而使反应速率加快,.故A不选;
B.温度降低,反应速率减小,故B选;
C.根据催化剂的定义可以知道,使用合适的催化剂,能够增大化学反应速率,故C不选;
D.增大固体反应物面积,化学反应速率加快,故D不选.
故选B.
本题解析:
本题难度:简单