微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列变化必须加入氧化剂才能完成的是( )
A.KMnO4→MnO2
B.Fe2+→Fe3+
C.I2→I-
D.Cl2→ClO-
参考答案:A、该转化中锰元素化合价降低了,加热KMnO4,无需加入还原剂就能实现,故A错误;
B、该转化中铁元素化合价升高了,需加入氧化剂才能实现,故B正确;
C、该转化中碘元素化合价降低了,需加入还原剂才能实现,故C错误;
D、该转化中氯元素化合价升高了,需加入氧化剂才能实现,故D正确.
故选BD.
本题解析:
本题难度:简单
2、简答题 对金属表面进行处理,形成一层致密的氧化物保护膜,是非常有效的一种金属防腐技术.
Ⅰ.钢铁“发蓝”是在钢铁表面形成一层致密的Fe3O4薄膜的技术.其中一种方法是将钢铁制品浸到NaNO2和浓NaOH的混合溶液中加热到130℃.其过程可以用如下化学方程式表示:
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOH
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
则反应②中的氧化剂是______(填化学式).
Ⅱ.铝的阳极氧化,也是一种常用的金属表面处理技术,它能使铝的表面生成一层特别致密的氧化膜,该氧化膜不溶于稀硫酸.某化学研究小组在实验室中按下列步骤模拟该生产过程.请填写下列空白:
(1)配制实验用的溶液.要配制500mL密度为1.2g?cm-3的溶质质量分数为16%的NaOH溶液,需要称取______g?NaOH固体.
(2)把铝片浸入热的16%?NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗.写出除去氧化膜有关反应的离子方程式:______.
(3)如图,组装好仪器,接通开关K,通电约25min.在阳极生成氧化铝,阴极产生气体.写出该过程中的电极反应式:阳极:______;阴极:______.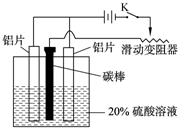
参考答案:Ⅰ.反应②中,NaNO2中氮元素的化合价由+3价降为-3价,化合价降低的元素所在的反应物是氧化剂,
故答案为:NaNO2;
Ⅱ、(1)NaOH的质量m=ρvw%=1.2g?cm-3×500mL×16%=96g,故答案为:96;
(2)氧化铝是两性氧化物,能溶于强碱溶液,离子方程式为:Al2O3+2OH-═2AlO-2+H2O,故答案为:Al2O3+2OH-═2AlO-2+H2O;
(3)电解池的阳极材料是铝时,则该电极反应是铝本身失电子的过程,即2Al+3H2O-6e-→Al2O3+6H+,阴极发生阳离子的得电子过程,在酸溶液中,为6H++6e-→3H2,故答案为:2Al+3H2O-6e-→Al2O3+6H+;6H++6e-→3H2↑.
本题解析:
本题难度:一般
3、选择题 为了实现下列各变化,需还原剂物质的是( )
A.KClO3→O2
B.NH4+→NH3
C.Fe→FeCl3
D.CO2→CO
参考答案:D
本题解析:
本题难度:简单
4、简答题 一个体重50kg的健康人含铁元素2g,这2g铁元素以Fe2+和Fe3+的形式存在.Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4).服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收.
(1)经常进行Fe2+与Fe3+的转化,可表示为Fe2+
Fe3+.在过程A中,Fe2+作______剂.
(2)维生素C可使食物中的Fe3+转化为Fe2+,维生素C在这个反应中具有______性.
(3)某同学要检验Fe3+,向溶液中加入______(写化学式)溶液变成红色.要除去FeCl3溶液中少量的氯化亚铁,可行的办法是______(填字母).
a.加入铜粉b.加入铁粉c.通入氯气d.加入NaOH溶液
根据选用的试剂,写出除去FeCl3溶液中少量的氯化亚铁过程中发生反应的离子方程式______.
(4)电子工业常用30%的FeCl3溶液腐蚀铜箔,制造印刷线路板,写出FeCl3与金属铜反应的离子方程式______.
(5)使用过的腐蚀液会失效,但可以回收利用,某兴趣小组为了从使用过的腐蚀液中回收铜,应使用的试剂是______(填字母)
a.铜粉b.氯气c.铁粉d.KSCN溶液.
参考答案:(1)由Fe2+A
本题解析:
本题难度:一般
5、选择题 河虾不宜与西红柿同食,主要原因是河虾中含+5价砷,西红柿中含有较多的维生素C,两者同食会产生有毒的+3价砷.据此,下列说法不正确的是( )
A.该反应中维生素C作还原剂
B.该反应中砷元素被氧化
C.河虾与西红柿同食发生了氧化还原反应
D.河虾与其它含维生素C较多蔬菜也不宜同食
参考答案:B
本题解析:
本题难度:一般