微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

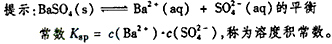
[? ]
A. 加入Na2SO4可以使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. a点对应的Ksp大于c点对应的Ksp
D. d点无BaSO4沉淀生成
参考答案:D
本题解析:
本题难度:一般
2、实验题 (12分)某科研小组在900℃的空气中合成出化学式为La2Ca2MnOx的超导体材料,其中La以+3价存在。为确定x的值,进行如下分析:
步骤1:准确称取0.5250g超导体材料样品,放入锥形瓶中,加25.00mL0.06000mol·L-1 Na2C2O4溶液(过量)和25mL 6mol·L-1 HNO3溶液,在6070℃下充分摇动,约半小时后得到无色透明溶液A(该条件下,只有Mn元素被还原为Mn2+,Na2C2O4被氧化为CO2)。
步骤2:用0.02000mol·L-1 KMnO4溶液滴定溶液A至终点,消耗10.00mL KMnO4溶液。
(1)步骤1反应后溶液中Mn2+的物质的量浓度为0.02000mol·L-1。常温下,为防止Mn2+形成Mn(OH)2沉淀,溶液的pH的范围为 [已知Mn(OH)2的Ksp=2.0×10-13]。
(2)步骤2滴定终点的现象是 。
(3)步骤2滴定终点读数时俯视刻度,其他操作都正确,则所测x的值将 (填“偏大”、“偏小”或“不变”)。
(4)求x的值(写出计算过程)。
参考答案:(1)pH≤8.5
(2)溶液变成浅红色,且半分钟内不褪色
(3)偏大
(4)样品溶解后,滴定消耗高锰酸钾:
10.00 mL×0.02000 mol·L-1="0.2000" mmol
2Mn 5C2
0.2000 mmol 0.5000 mmol
样品溶解过程所消耗的C2量:
25.00 mL×0.06000 mol·L-1-0.5000 mmol="1.000" mmol
La2Ca2MnOx中Mn的化合价为(2x-10)
La2Ca2MnOx中锰得电子数与C2失电子数相等:
×(2x-10-2)=2×1.000×10-3
解得:x=7
本题解析:(1)已知Mn(OH)2的Ksp=2.0×10-13=c(Mn2+)×c(OH-)2,c(OH-)= =
= mol/L, c(H+)=
mol/L, c(H+)= =
= ,pH=8.5,要防止锰离子变成氢氧化锰沉淀,故pH≤8.5;
,pH=8.5,要防止锰离子变成氢氧化锰沉淀,故pH≤8.5;
(2)当溶液变成浅红色,且半分钟内不褪色时,说明到达了滴定终点;
(3)终点读数时俯视刻度时,会导致滴定结果偏大;
(4)样品溶解后,滴定消耗高锰酸钾:
10.00 mL×0.02000 mol·L-1="0.2000" mmol
2Mn2+---------------5C2O42-
0.2000 mmol 0.5000 mmol
样品溶解过程所消耗的C2O42-量:25.00 mL×0.06000 mol·L-1-0.5000 mmol="1.000" mmol
La2Ca2MnOx中Mn的化合价为(2x-10) ,La2Ca2MnOx中锰得电子数与C2O42-失电子数 相等:
 ×(2x-10-2)=2×1.000×10-3 解得:x=7
×(2x-10-2)=2×1.000×10-3 解得:x=7
考点:滴定终点的判断,滴定的相关计算,pH的计算
本题难度:困难
3、填空题 (18分)氮、硫、氯及其化合物是中学化学重要的组成部分。
(1)氨气燃料电池使用的电解质溶液是KOH溶液,电池反应为: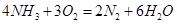 。该电池负极的电极反应式为__________;用该电池进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,以CuSO4溶液为电解质溶液,下列说法正确的是____________.
。该电池负极的电极反应式为__________;用该电池进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,以CuSO4溶液为电解质溶液,下列说法正确的是____________.
a.电能全部转化为化学能
b. 的物质的量浓度不变(不考虑溶液体积变化)
的物质的量浓度不变(不考虑溶液体积变化)
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
e.若阳极质量减少64g,则转移电子数为2NA个
(2)①将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:所得悬浊液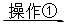 白色沉淀
白色沉淀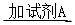 观察现象并判断。则试剂A的化学式为_________。实验表明,加入试剂A后,白色沉淀未见溶解,产生该白色沉淀的离子方程式是___________。
观察现象并判断。则试剂A的化学式为_________。实验表明,加入试剂A后,白色沉淀未见溶解,产生该白色沉淀的离子方程式是___________。
②利用如图所示电化学装置吸收工业尾气中SO2,阴极上生成Cu。写出装置中阳极的电极反应式__________。

(3)已知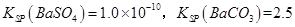
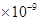 。某同学设想用下列流程得到BaCl2,
。某同学设想用下列流程得到BaCl2,
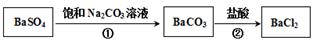
则①的离子方程式为_________,该反应的平衡常数K=__________;
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
I.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液,发生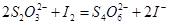 反应
反应
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如图所示:

请回答:
①确定操作Ⅱ完全反应的现象是___________。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是__________。
参考答案:(1)2NH3-6e-+6OH-=N2+6H2O;bd。(2)①HCl;2SO2+2Ba2++O2+2H2O=2BaSO4+4H+,②SO2+2H2O-2e-=4H++2SO42-(3)BaSO4+CO32- BaCO3+SO42-0.04(4)①溶液蓝色褪去,②ClO2-+4I-+4H+=Cl-+2I2+2H2O(每空2分)
BaCO3+SO42-0.04(4)①溶液蓝色褪去,②ClO2-+4I-+4H+=Cl-+2I2+2H2O(每空2分)
本题解析:(1)氨气燃料电池中氨气中的氮元素化合价升高,在负极反应,所以负极的电极反应为:2NH3-6e-+6OH-=N2+6H2O;a电解装置不可能将电能全部转化为化学能,还有热能,错误;b硫酸根离子在电解精炼中没有反应,不变,正确;c铜离子向阴极移动,错误;d阳极上比铜活波的金属反应,比铜不活波的金属会作为阳极泥落下来,正确;e阳极是铝、锌等先反应,所以阳极质量减少了64克,不是铜减少了64克,不能计算转移电子数,错误。所以选bd。(2)①所得的悬浊液经过过滤得到白色沉淀,在加入盐酸看沉淀是否溶解,若未溶解,说明反应过程中二氧化硫被氧气氧化成了硫酸根离子,所以反应的离子方程式为:2SO2+2Ba2++O2+2H2O=2BaSO4+4H+。②若用电解法吸收尾气中的二氧化硫,则二氧化硫在阳极失去电子变成硫酸根离子,电极反应为:SO2+2H2O-2e-=4H++SO42-(3)因为Ksp(BaSO4)<Ksp(BaCO3),所以硫酸钡可以转变成碳酸钡,BaSO4(s)+CO32-(aqs) BaCO3(s)+SO42-(aq),其平衡常数等于Ksp(BaSO4)/<Ksp(BaCO3)=0.04。(4)①操作Ⅱ使碘单质反应,所以完全反应的现象为溶液蓝色褪去。②pH至1~3,溶液中的离子从ClO2-变成Cl-,氯元素的化合价降低,所以碘元素的化合价升高,从-1价的碘离子变成碘单质,溶液又显蓝色。ClO2-+4I-+4H+=Cl-+2I2+2H2O
BaCO3(s)+SO42-(aq),其平衡常数等于Ksp(BaSO4)/<Ksp(BaCO3)=0.04。(4)①操作Ⅱ使碘单质反应,所以完全反应的现象为溶液蓝色褪去。②pH至1~3,溶液中的离子从ClO2-变成Cl-,氯元素的化合价降低,所以碘元素的化合价升高,从-1价的碘离子变成碘单质,溶液又显蓝色。ClO2-+4I-+4H+=Cl-+2I2+2H2O
考点:电解精炼,难溶电解质的转化,氧化还原反应
本题难度:困难
4、选择题 在pH为4-5的环境中,Cu2+和Fe2+不水解,而Fe3+几乎完全水解.工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右.在漫漫加入粗氧化铜(含杂质FeO),充分搅拌使之溶解.欲除去所得CuCl2溶液中的杂质离子,下列方法中可行的是( )
A.加入HNO3将Fe2+氧化成Fe3+,再加水稀释至pH4-5
B.向溶液中通入Cl2,再加入CuO粉末调节至pH4-5
C.向溶液中通入Cl2,在通入NH3调节至pH4-5
D.向溶液中通入H2O2,再加入CuO粉末调节至pH4-5
参考答案:A.加入HNO3将Fe2+氧化成Fe3+,再加水稀释至pH4-5,溶液中引入了硝酸根离子,故A错误;
B.在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀,要除去溶液中的Fe2+离子,应先加入Cl2,再加入CuO粉末调节pH为4~5,以除去Fe3+,且没有引入新的杂质,故B正确;
C.在溶液中通入Cl2,再通入NH3调节pH会引入新的杂质,故C错误.
D.向溶液中通入H2O2,将Fe2+氧化成Fe3+,过氧化氢被还原为水,不引入新的杂质,再加入CuO粉末调节至pH4-5,使三价铁离子沉淀除去,故D正确;
故选BD.
本题解析:
本题难度:简单
5、选择题 下列图示与对应的叙述相符的是?
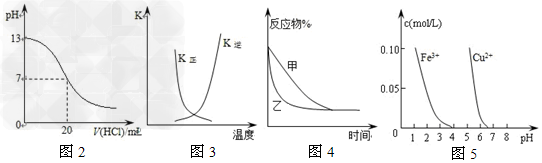
[? ]
A.图2表示25℃时,用0.1?mol/L盐酸滴定20?mL?0.1?mol/LNaOH溶液,溶液的pH随加入酸体积的变化
B.图3中曲线表示反应2A(g)?+?B(g) 2C(g)?ΔH?>?0,正、逆反应的平衡常数K随温度的变化
2C(g)?ΔH?>?0,正、逆反应的平衡常数K随温度的变化
C.图4表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D.据图5,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右
参考答案:D
本题解析:
本题难度:一般