微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列对反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O的叙述正确的是
MnCl2+Cl2↑+2H2O的叙述正确的是
[? ]
A.反应中氧化剂与还原剂的物质的量之比为1:4
B.盐酸在反应中既表现酸性又表现还原性
C.含4 mol HCl的浓盐酸与足量MnO2反应最多生成1 mol Cl2
D.生成的氯气可用于环境消毒
参考答案:B
本题解析:
本题难度:一般
2、选择题 已知S2O8n-离子和H2O2一样含过氧键,因此也有强氧化性,S2O8n-离子在一定条件下可把Mn2+氧化成MnO4-离子,若反应后S2O8n-离子生成SO42-离子;又知反应中氧化剂与还原剂的离子数之比为5:2则S2O8n-中的n值和S元素的化合价是?
[? ]
A、2, +7
B、2, +6
C、4 ,+7
D、4 , +4
参考答案:A
本题解析:
本题难度:一般
3、选择题 向含有0.078molFeCl2的溶液中通入0.009molCl2,再向其中加入含0.01molX2O72-的酸性溶液,使溶液中的Fe2+恰好完全被氧化,且X2O72-被还原为Xn+,则n值为( )
A.2
B.3
C.4
D.5
参考答案:B
本题解析:
本题难度:一般
4、选择题 在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,1molCuSO4能氧化磷的物质的量是
A.?mol
B.?mol
C.?mol
D.?mol
参考答案:B
本题解析:分析:首先分析反应中各元素的化合价变化,Cu的价态由+2→+1(还原),11mol P元素中6mol化合价升高(氧化)、5mol 化合价降低(还原),可见被氧化的6mol P,是被Cu(+2)和另一部分P共同氧化的.再分析电子得失数目发现,6mol 被氧化的P共失电子30mol,其中Cu(+2)得15mol,另一部分P得另15mol.即15mol CuSO4所氧化的P为3mol,则1mol CuSO4氧化P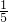 mol.
mol.
解答:首先分析反应中各元素的化合价变化,Cu的价态由+2→+1(还原),11mol P元素中6mol化合价升高(氧化)、5mol化合价降低(还原),可见被氧化的6mol P,是被Cu(+2)和另一部分P共同氧化的.
由电子得失数目可知,6mol 被氧化的P共失电子6mol×5=30mol,其中Cu(+2)得15mol,另一部分P得另15mol.即15mol CuSO4所氧化的P为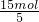 =3mol,则1mol CuSO4氧化P
=3mol,则1mol CuSO4氧化P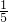 ?mol.
?mol.
故选B.
点评:本题考查氧化还原反应基本概念与计算,难度中等,关键根据化合价判断氧化剂与还原剂,可以直接利用Cu(+2)得电子等于CuSO4氧化的磷得电子数守恒计算,更为简单.
本题难度:困难
5、选择题 能与Fe3+反应,且能证明Fe3+具有氧化性的是
①SCN-? ②Fe? ③Fe2+? ④Cu? ⑤Zn? ⑥OH-
A.①②③
B.②④⑤
C.①③⑥
D.①②⑤
参考答案:B
本题解析:②④⑤均具有还原性,能被铁离子氧化,答案选B。
本题难度:简单