微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)已知反应:2H2CrO4 + 3H2O2?2Cr(OH)3 + 3O2↑+ 2H2O该反应中H2O2只发生如下变化过程:H2O2→O2
(1)该反应中的还原剂是??
(2)用单线桥法表示反应中电子转移的方向和数目
2H2CrO4 + 3H2O2?2Cr(OH)3 + 3O2↑+ 2H2O
(3)如反应中转移了0.6mol电子,则产生的气体在标准状况下体积为?
参考答案:(6分)
(1)H2O?
(2)2H2CrO4 + 3H2O2?2Cr(OH)3 + 3O2↑+ 2H2O
(3)? 6.72L?
本题解析:略
本题难度:一般
2、选择题 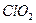 是一种常用的预防“禽流感”的消毒剂,可通过以下反应制得(未配平):
是一种常用的预防“禽流感”的消毒剂,可通过以下反应制得(未配平):
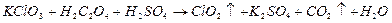
下列说法正确的是?
A.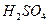 做氧化剂
做氧化剂
B.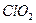 是氧化产物
是氧化产物
C.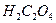 被氧化
被氧化
D.每消耗lmol 就有2mol电子转移
就有2mol电子转移
参考答案:C
本题解析:略
本题难度:一般
3、计算题 写出符合下列条件的氧化还原反应方程式
A.一种单质氧化另一种单质
B.一种单质氧化一种化合物
C.一种化合物氧化另一种化合物
D.一种化合物氧化一种单质
参考答案:A.C+O2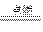 CO2, B.2CO+O2
CO2, B.2CO+O2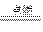 2CO2,C.MnO2+4HCl(浓)
2CO2,C.MnO2+4HCl(浓)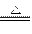 ?MnCl2+Cl2↑+2H2O,D.CuO + H2
?MnCl2+Cl2↑+2H2O,D.CuO + H2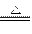 Cu+H2O。
Cu+H2O。
本题解析:本题能力层次为C。甲物质氧化乙物质时,甲物质得到电子,有元素的化合价降低,乙物质失去电子,有元素的化合价升高。
学法指导:氧化还原反应的本质是电子的转移(得失或偏移)。表现为反应前后元素的化合价发生改变,故化合价是分析氧化还原反应的基础。氧化剂具有氧化性,能氧化其他物质,含有化合价降低的元素。
本题难度:简单
4、填空题 铁盐、亚铁盐是实验室常用的药品。根据题意完成下列填空:
(1)若向硫酸亚铁溶液中滴加稀硝酸,可以看到溶液逐渐变黄。为检验最后溶液中是否还有亚铁离子剩余,可以_____________________________________________;向已酸化的FeCl3溶液中逐滴加入Na2S溶液,有浅黄色沉淀生成,溶液逐渐变为浅绿色。写出该反应的离子方程式?。
(2)向FeSO4溶液中加几滴硫氰化钾溶液,无现象,再滴加H2O2,溶液变红,继续滴加H2O2,红色逐渐褪去,且有气泡产生。呈红色的物质是?(写化学式)。
已知:11H2O2+2SCN—→2SO42—+2CO2↑+ N2↑+10H2O +2H+若生成1mol N2,H2O2和SCN—的反应中转移电子物质的量是?mol。
(3)由以上实验,推断Fe2+、S2—和SCN—的还原性强弱?(按从强到弱顺序排列)。
(4)向FeCl3溶液中加入KOH溶液至过量,微热,再通入Cl2,可观察到溶液呈紫色(高铁酸钾:K2FeO4)。写出此过程的离子方程式、配平并标出电子转移的数目和方向?。
参考答案:(1)取样,在样品中滴加酸性高锰酸钾溶液,若紫色褪去,则说明亚铁离子有剩余;(2分);2Fe3++S2—→2Fe2+ +S↓;
(2)Fe(SCN)3 (合理即可);22
(3)S2—>Fe2+>SCN—
(4) (方程式1分,方向和数目1分)
(方程式1分,方向和数目1分)
本题解析:(1)Fe2+ 有还原性,Fe3+ 有较强还原性,所以要检验Fe2+ 可以加入有颜色变化的氧化剂,所以可以往样品中加入酸性高锰酸钾溶液,若紫色褪去,则说明Fe2+ 有剩余;而因为Fe3+ 的氧化性,所以加入还原性的Na2S,S2— 被氧化为S单质析出淡黄色沉淀,离子方程式为2Fe3++S2—=2Fe2+ +S↓。
(2)Fe2+?被加入的氧化剂H2O2 氧化为Fe3+ ,所以生成铁离子与加入的SCN-发生络合反应,生成红色的Fe(SCN)3;由于加入的H2O2和SCN—发生氧化还原反应,H2O2 中的O化合价从-1价→-2价,S化合价-2→+6、N化合价-3→0价,所以从化合价升降可以判断H2O2 为氧化剂,当生成1mol N2 ,消耗H2O2 11mol,转移22mol电子。
(3)根据氧化还原规律,由上述几个反应可知Fe3+ 可以氧化S2— ,而不能氧化SCN— ,还原性S2—>SCN—同样Fe2+ 不能氧化SCN— ,所以可知三者还原性S2—>Fe2+>SCN— 。
(4)向FeCl3溶液通入强氧化性的氯气,生成了紫色的高铁酸钾,铁的化合价升高,铁元素被氧化,在碱性溶液中发生氧化还原反应,根据电子的是守恒配平得方程式为: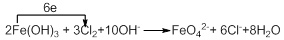 。
。
本题难度:困难
5、填空题 根据反应8NH3+3Cl2====6NH4Cl+N2回答下列问题。
(1)氧化剂_________,还原剂_________;
(2)反应中转移电子数是_________;
(3)氧化剂与氧化产物的质量比_________;
(4)当生成28gN2时,被氧化的物质的质量是_________g。
参考答案:(1)Cl2NH3(2)6e-(3)213∶28(4)34
本题解析:该反应中8分子NH3参与反应时,2分子NH3中的N的化合价升高,所以还原剂为NH3,氧化产物为N2,Cl2中Cl的化合价降低,被还原,为氧化剂。其中转移的电子数目为6e-,氧化剂与氧化产物的质量比为3×71∶28,即213∶28,当生成28gN2时,参与反应的NH3为136g,被氧化只有25%,所以为34g。
本题难度:简单