微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 现向一固定容积密闭容器中充入2mol?N2和3mol?H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g),能说明该反应达到化学平衡状态的是( )
A.N2、H2、NH3的浓度相等
B.容器内N2、H2、NH3混合气体的密度不再变化
C.单位时间内,生成n?mol?N2,同时生成2n?mol?NH3
D.反应停止,正、逆反应速率都等于零
参考答案:A.当N2、H2、NH3的浓度相等时,该反应不一定达到平衡状态,与反应物初始浓度和转化率有关,故A错误;
B.该容器中混合气体的总质量不变,容器的体积不变,所以密度始终不变,则密度不能作为判断平衡状态的依据,故B错误;
C.单位时间内,生成n?mol?N2,同时生成2n?mol?NH3,同时有2nmol氮气参加反应,所以氮气的正逆反应速率相等,该反应达到平衡状态,故C正确;
D.反应达到平衡状态时,正逆反应速率相等但反应不停止且反应速率不为0,故D错误;
故选C.
本题解析:
本题难度:一般
2、填空题 在溶液中,反应A+2B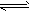 C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为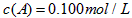 、
、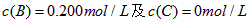 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。
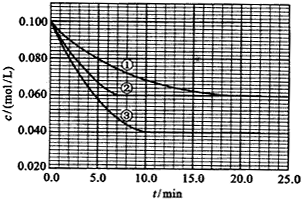
请回答下列问题
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②__________________________; ③_______________________________;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;
(3)该反应的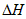 _________0,判断其理由是__________________;
_________0,判断其理由是__________________;
(4)该反应进行到4.0min时的平均反应速度率:实验②: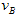 =____________;实验③:
=____________;实验③: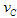 =_________。
=_________。
参考答案:
(1)②加催化剂,达到平衡的时间缩短,平衡时A的浓度未变;③温度升高,达到平衡的时间缩短,平衡时A的浓度减小
(2)40%(或0.4);0.06mol/L;
(3)>;升高温度向正方向移动,故该反应是吸热反应
(4)0.014mol(L·min)-1;0.008mol(L·min)-1
本题解析:
本题难度:一般
3、填空题 已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃
| 700
| 800
| 830
| 1000
| 1200
|
平衡常数
| 1.7
| 1.1
| 1.0
| 0.6
| 0.4
|
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“>”“<”或“=”);
(2)830℃时,向一个5L密闭容器中充入0.20 mol A和0.80 mol B,如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1,则6s时c(A)= mol·L-1,C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为
,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母);
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为
A(g)+B(g)的平衡常数的值为
参考答案:(1)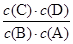 <
<
(2)0.022; 0.09; 80%;80%(3)c(4)2.5
本题解析:(1)可逆反应A(g)+B(g)?C(g)+D(g)的平衡常数表达式k=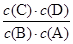 由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应是放热反应,即△H<0,
由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应是放热反应,即△H<0,
(2)反应初始6s内A的平均反应速率v(A)=0.003mol?L-1?s-1,则6s内△c(A)=0.003mol?L-1?s-1×6s=0.018mol/L,A的起始浓度为0.2mol/5L=0.04mol/L,故6s时时c(A)=0.04mol/L-0.018mol/L=0.022mol/L,
故6s内△n(A)=0.018mol/L×5L=0.09mol,由方程式可知n(C)=△n(A)=0.09mol,
设平衡时A的浓度变化量为x,则:
A(g)+B(g)?C(g)+D(g)
开始(mol/L):0.04 0.16 0 0
变化(mol/L):x x x x
平衡(mol/L):0.04-x 0.16-x x x
故x2/(0.04-x)( 0.16-x)=1,解得x=0.032
所以平衡时A的转化率为0.032/0.04×100%=80%
体积不变,充入1mol氩气,反应混合物各组分的浓度不变,变化不移动,A的转化率不变为80%,
(3)a.该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变,不能说明到达平衡,故a错误, b.混合气体的总质量不变,容器的容积不变,故混合气体的密度始终不变,故气体的密度不随时间改变,不能说明到达平衡,故b错误,c.可逆反应到达平衡时,各组分的浓度不发生变化,故c(A)不随时间改变,说明到达平衡,故c正确,d.单位时间里生成C和D的物质的量相等,都表示正反应速率,反应始终按1:1生成C、D的物质的量,不能说明到达平衡,故d错误,故答案为:c;
(4)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数,故1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为1/0.4=2.5,
考点:化学平衡计算、平衡常数计算、化学反应速率、平衡状态判断
本题难度:困难
4、填空题 二氧化碳捕集、存储和转化是当今化学研究的热点问题之一。
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2,发生反应:2CO2(g)=2CO(g)+O2(g),该反应的ΔH 0,ΔS 0(选填“>”、“<”或“=”),在低温下,该反应 (填“能”或“不能”)自发进行。
(2)CO2转化途径之一是利用太阳能或生物质能分解水制H2,然后将H2与CO2转化为甲醇或其他化学品。你认为该方法需要解决的技术问题有 。
a.开发高效光催化剂
b.将光催化制取的氢气从反应体系中有效分离,并与CO2发生催化转化
c.二氧化碳及水资源的供应
参考答案:(1)> > 不能 (2)ab
本题解析:该反应是分解反应,且CO燃烧时放热,所以该反应为吸热反应,即ΔH>0,因气体的物质的量增多,所以ΔS>0。ΔG=ΔH-TΔS<0时,反应可自发进行,所以在低温下,该反应不能自发进行。
本题难度:一般
5、填空题 (16分)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
(1)已知:①2CO(g)+O2(g)=2CO2(g) ?H1="a" kJ?mol-1
②2NO(g)+2CO(g) ?N2(g)+ 2CO2(g) ?H2="b" kJ?mol-1
则反应N2(g)+ O2(g)= 2NO(g)的?H= kJ?mol-1(用a、b表示)。
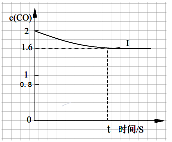
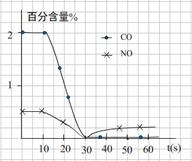
(2)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,20S反应达平衡,此时CO的物质的量为1.6 mol。请回答下列问题:
①前20S内平均反应速率v(NO)为 。
②在该温度下反应的平衡常数K= 。
③关于上述反应,下列叙述不正确的是 (填编号)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入0.4molCO和0.8mol N2,则此时v正>v逆