微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验。
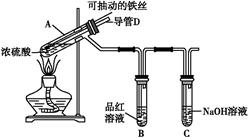
(1)实验过程中,观察到B中的实验现象是? 。
一段时间后,观察到从C中有少量的气泡冒出,此气泡的成分是 ?。
(2)用“可抽动的铁丝”代替“直接投入铁片”的优点是? ;
反应结束后,不需要打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是? 。
(3)反应一段时间后,他们对A中溶液的金属阳离子进行了探究。
①提出假设:
假设1:溶液中只存在Fe2+;
假设2: ?;?
假设3:溶液中存在Fe2+和Fe3+。
②请你设计实验验证上述假设1,写出实验操作步骤、实验现象及结论。限选试剂:酸性KMnO4溶液、NaOH溶液、淀粉KI溶液、KSCN溶液。
?
参考答案:(1)品红溶液褪色 H2
(2)便于控制铁与浓硫酸的反应和停止 从D管口向A中鼓入大量的空气
(3)①溶液中只存在Fe3+
②
实验操作步骤
实验现象
结论
方法一:取少量A中溶液分别加入甲、乙两支试管中;甲中滴加少量酸性高锰酸钾溶液;乙中滴加少量KSCN溶液
甲中高锰酸钾溶液褪色;乙中KSCN溶液不变红
溶液中存在Fe2+,不存在Fe3+
方法二:取少量A中溶液加入试管中,滴入少量KSCN溶液,一段时间后再加入少量氯水
加入KSCN溶液不显红色,继续加入少量氯水,溶液显红色
溶液中不存在Fe3+,存在Fe2+
本题解析:(1)A中开始可能发生的反应有:2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O、Fe+Fe2(SO4)3
Fe2(SO4)3+3SO2↑+6H2O、Fe+Fe2(SO4)3 3FeSO4,随着反应的进行,浓硫酸变为稀硫酸,铁与稀硫酸反应产生氢气。
3FeSO4,随着反应的进行,浓硫酸变为稀硫酸,铁与稀硫酸反应产生氢气。
(2)将抽动的铁丝脱离液面,反应停止,将抽动的铁丝插入液面,反应开始;鼓入空气将试管内的气体排出。
(3)检验Fe2+时必须防止Fe3+的干扰,Fe3+与酸性高锰酸钾溶液不反应,而Fe2+具有较强的还原性,因此Fe2+能使酸性高锰酸钾溶液褪色,选择酸性高锰酸钾溶液。但必须还要证明溶液中不含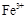 选用KSCN溶液。
选用KSCN溶液。
本题难度:一般
2、填空题 铁及其化合物在日常生活中应用广泛,请回答下列问题:
(1)Fe(NO3)3·9H?2?O易溶于水,微溶于硝酸,主要用作催化剂和媒染剂,工业上用细铁屑与稀硝酸反应制备,主要流程如下:
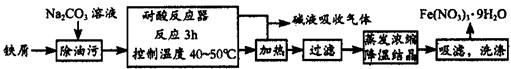
①Na2CO3溶液可以除油污,原因是(用离子方程式表示)_________________________;
②耐腐反应器中可以观察到如下的现象:铁屑__________,溶液颜色变为__________,有______色气体产生;制备过程中需控制加入铁屑的量,当观察到_______________的现象时应停止加入铁屑;
③制得的Fe(NO3)3·9H?2?O用20% HNO3洗涤,其原因是_________________________。
④若在实验中进行蒸发浓缩、降温结晶的操作,除带铁圈的铁架台、坩埚钳外,还需要的主要仪器有___________。
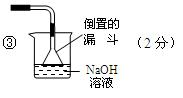
(2)某兴趣小组在实验室用细铁屑和稀硝酸制备Fe(NO3)3,装置如右图所示(固定所用仪器和加热装置未画出)。
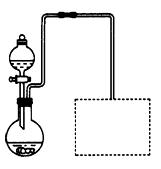
①该实验中对圆底烧瓶加热的最佳方式用_ _________加热;
_________加热;
②装置中圆底烧瓶上方长导管的作用是_________________;
③请在图中虚线框内画出防止倒吸的尾气吸收装置。(提示:碱液可快速、充分吸收产生的氮的氧化物气体)
参考答案:(1) ① CO32-+ H2O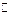 HCO3-+OH-(2分)
HCO3-+OH-(2分)
② 溶解,黄色,无,反应器中产生气泡的速率明显变慢(4分)
③ 洗去晶体表面附着的杂质且降低洗涤过程中晶体的消耗(2分)
④ 酒精灯、蒸发皿、玻璃棒(2分)
(2) ①水浴(2分)?②导气兼冷凝回流(2分)
本题解析:略
本题难度:一般
3、选择题 向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL 1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标况)气体,所得溶液加KSCN溶液无血红色出现,那么若用足量的CO在高温下还原相同质量的混合物,能得到铁( )
A.11.2g
B.2.8g
C.5.6g
D.无法计算
参考答案:盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeCl2溶液,根据氯元素守恒可知n(FeCl2)=12n(HCl)=12×0.1L×1mol/L=0.05mol;
用足量的CO在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知n(Fe)=n(FeCl2)=0.05mol,质量为0.05mol×56g/mol=2.8g.
故选:B.
本题解析:
本题难度:一般
4、计算题 10gFe-Mg合金溶解在一定量的某浓度的稀硝酸中,当金属完全反应后,收集到标况下4.48LNO气体(设还原产物只有NO,铁只生成Fe2+)。
(1)反应中被还原的硝酸物质的量是多少
(2)在反应后的溶液中加入足量的NaOH溶液,可得多少克沉淀?
参考答案:(3 分)(1)0.2mol?(5分)
分)(1)0.2mol?(5分)
(2)因为Mg,Fe失电子数等于氮元素得电子数。
n失=n得=4.48L÷22.4L.mol-1×3=0.6mol?Fe,Mg失电子后的阳离子所带正电荷共为0.6mol,它也等于沉淀该阳离子所需OH-的物质的量。即n(OH-)=0.6mol。m沉淀=m阳+m(OH-)=10g+0.6mol×17g.mol-1=20 .2g
.2g
本题解析:略
本题难度:一般
5、填空题 (8分)阅读下列材料后,回答相应问题。
一个体重50Kg的健康人,含铁2g。这2g铁在人体中不是以单质金属的形式存在的,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利与铁的吸收。
(1)人体中经常进行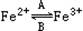 的转化,A中Fe2+做?剂,B中Fe3+做?剂。
的转化,A中Fe2+做?剂,B中Fe3+做?剂。
(2) “服用维生素C,可使食物中的三价铁离子还原成二价铁离子。”这句话指出维生素C在这一反应中做?剂,具有?性。
参考答案:(1 )还原剂?氧化剂?(2)还原剂?还原性
)还原剂?氧化剂?(2)还原剂?还原性
本题解析:略
本题难度:简单