|
高考化学知识点归纳《弱电解质电离平衡》高频考点特训(2017年练习版)(四)
2017-09-23 22:47:23
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 室温下,下列说法正确的是?
[? ]
A.将pH=1的H2SO4和pH=3的HCl等体积混合,所得溶液pH=2
B.HF比HCN易电离,则NaF溶液的pH比同浓度NaCN溶液的pH大
C.向0.1?mol/LCH3COOH溶液中加入少量CH3COONa固体,溶液中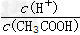 增大 增大
D.将1?mL?pH=3的HX溶液稀释到10?mL,若溶液的pH<4,则HX为弱酸
参考答案:D
本题解析:
本题难度:一般
2、选择题 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
A.稀释前,c(A)=10?c(B)
B.稀释前,A溶液中由水电离出的OH-的浓度大于10-7?mol/L
C.在M点,A、B两种碱溶液中阳离子的物质的量浓度相等
D.用醋酸中和A溶液至恰好完全反应时,溶液的pH为7
| 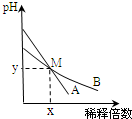
参考答案:A、稀释前,c(AOH)=0.1mol/L,c(BOH)>0.01mol/L,则c(AOH)<10c(BOH),故A错误;
B、稀释前A溶液中氢氧根离子浓度大于B溶液中;碱是抑制水的电离;稀释前,A溶液中由水电离出的OH-的浓度小于10-7?mol/L,故B错误;
C、M点AB溶液pH相同,氢氧根离子浓度相同,所以M点A、B两种碱溶液中阳离子的物质的量浓度相等,故C正确;
D、用醋酸中和A溶液至恰好完全反应时,醋酸是弱酸,生成的醋酸根离子水解显碱性,故D错误;
故选C.
本题解析:
本题难度:一般
3、选择题 相同温度,浓度均为0.1mol /L,等体积的三种溶液:①HF溶液、②CH3COOH溶液、③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)的变化如右图所示,下列说法正确的是(? )
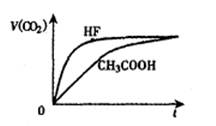
A.上述三种溶液中:c( OH-)大小:③ > ② > ①
B.物质酸性的比较:CH3COOH > HF > H2CO3
C.反应结束后所得两溶液中: c ( CH3COO- ) > c ( F- )
D.①和③反应结束后所得溶液中:c ( F- ) + c (HF) =" 0.10mol" /L
参考答案:A
本题解析:A.由于相同浓度的HF与NaHCO3反应放出CO2比CH3COOH溶液快。说明溶液的酸性HF> CH3COOH>H2CO3。溶液的酸性越强,c(H+)越大,则根据水的离子积常数可得c( OH-)就越小。因此c( OH-)大小:③ > ② > ①。正确。B. 物质酸性的比较:HF >CH3COOH > H2CO3。错误。C. 反应结束后,由于放出的CO2体积相同,所以含有的酸根离子的浓度也相等。D. ①和③反应结束后所得溶液中:c ( F- ) + c (HF)? =" 0.05mol" /L .错误。
本题难度:一般
4、选择题 下列对各种平衡体系的叙述中,完全正确的一组是( )
①中和10mL0.1mol/L的氨水与中和100mL0.01mol/L的氨水,所需同一浓度盐酸的体积不同;
②常温下,在CH3COONa溶液中加入少量冰醋酸,会使其水解平衡逆向移动;
③某温度下,容积一定的密闭容器中进行可逆反应:X(g)+Y(g)?2Z(g)+W(g)△H>0,平衡后,升高温度,c(Z)增大;
④高温加热MgCl2?6H2O晶体的产物为MgCl2和H2O;
⑤一定浓度的碳酸钠溶液可使酚酞试液变红,其原因是溶液中存在如下平衡:CO32-+H2O?HCO3-+OH-,使得溶液中的c(OH-)>c(H+);
⑥在碳酸钙的沉淀溶解平衡体系中,通入CO2气体,平衡向溶解的方向移动;
⑦在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀.
A.①②③④⑤
B.②③④⑤⑥
C.②③⑤⑥⑦
D.①②⑤⑥⑦
参考答案:①因O.OL×0.1moL/L=0.1L×0.01moL/L,则溶质的物质的量相同,消耗的盐酸的物质的量也相同,故错误;
②醋酸钠水解生成醋酸,加入冰醋酸,醋酸浓度增大,则平衡向逆向移动,故正确;
③正反应吸热,温度升高,平衡向正反应方向移动,c(Z)增大,故正确;
④加热氯化镁溶液,促进镁离子的水解,最终得到氢氧化镁,故错误;
⑤碳酸钠为强碱弱酸盐,水解呈碱性,可使酚酞试液变红,故正确;
⑥碳酸钙溶液中通入二氧化碳,可生成碳酸氢钙,平衡向溶解的方向移动,故正确;
⑦碘化银的溶度积小于氯化银,则在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀,故正确.
故选C.
本题解析:
本题难度:一般
5、选择题 常温时,下列叙述正确的是( )
A.稀释pH=10的氨水,溶液中所有离子的浓度均降低
B.pH均为5的HCl和NH4Cl溶液中,水的电离程度相同
C.NaOH和CH3COONa的混合溶液中,c(Na+)+c(H+)═c(OH-)+c(CH3COO-)
D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多
参考答案:A.稀释氨水,促进一水合氨电离,溶液中氢氧根离子浓度减小,水的离子积常数不变,则氢离子浓度增大,故A错误;
B.盐酸抑制水电离,氯化铵促进水电离,所以两种溶液中水的电离程度不同,故B错误;
C.根据电荷守恒得c(Na+)+c(H+)═c(OH-)+c(CH3COO-),故C正确;
D.等体积等pH的醋酸和硫酸,醋酸的物质的量大于硫酸中氢离子的物质的量,所以分别中和pH与体积均相同的硫酸和醋酸,醋酸消耗氢氧化钠的物质的量多,故D错误;
故选C.
本题解析:
本题难度:一般
| 