微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在1molP原子形成的白磷中含有P—P键为(NA为阿氏常数)
A.3NA? B.1.5 NA? C? 4 NA? D 0.25 NA
参考答案:B
本题解析:略
本题难度:简单
2、简答题 (1)已知拆开1mol?H-H键、1mol?I-I键、1mol?H-I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘单质反应生成1mol?HI需要?(填“放出”或“吸收”)?kJ的热量.氢气、碘单质和碘化氢三种分子最稳定的是?.
(2)下列五种物质中①Ne?②H2O?③NH3?④KOH?⑤Na2O,只存在共价键的是?,只存在离子键的是?,既存在共价键又存在离子键的是?,不存在化学键的是?.(填写序号)
(3)按要求填空:
①推测Si、N?间氢化物的稳定性;?>?(填化学式)?
②C:?周期?族;
③3416S2-微粒中的质子数是?,中子数是?,核外电子数是?.
(4)对于反应2S02+02

2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的S03的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”).
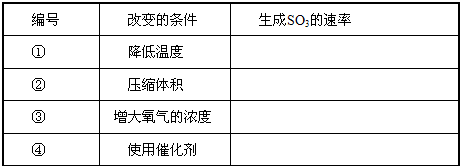
参考答案:(1)由氢气和碘单质反应生成1mol?HI,则需断裂0.5molH-H和0.5molI-I键,
吸收的能量为:0.5×436kJ+0.5×151kJ=293.5kJ,
生成1mol?HI分出的能量为:299kJ,
所以该反应放热,放出的能量为:299kJ-293.5kJ=5.5kJ,三种物质中键能最大的是H2,则最稳定的是H2,
故答案为:放出;5.5;H2;
(2)共价键是有非金属原子之间通过共用电子对形成的化学键,离子键是离子之间的静电作用,存在离子化合物中,
①Ne为单原子分子,不存在化学键;?②H2O、③NH3为共价化合物,只存在共价键,
?④KOH?为离子化合物,既含有离子键,又含有共价键,⑤Na2O为离子化合物,只含有离子键,
故答案为:②③;⑤;④;①;
(3)①N元素的非金属性大于Si元素,非金属性越强,对应的氢化物越稳定,
故答案为:NH3,SiH4;
?②C的原子序数为6,核外有2个电子层,最外层电子数为4,位于周期表第二周期第IVA族,故答案为:二,IVA;?
③3416S2-微粒中,质子数为16,中子数为34-16=18,电子数为16+2=18,
故答案为:16,18,18;
(4)在可逆反应中,增大压强、升高温度,增大反应物的浓度以及使用催化剂都能增大反应速率,反之,反应速率减小,
故答案为:
?编号?改变的条件?生成S03的速率?①?降低温度?减小?②?压缩体积?增大?③?增大氧气的浓度?增大?④?使用催化剂?增大
本题解析:
本题难度:一般
3、选择题 元素X、Y、Z原子序数之和为33,X、Y在同一周期,X+与Z2—具有相同的核外电子层结构。下列推测不正确的是(?)?
A.同周期元素中X的金属性最强
B.同族元素中Z的氢化物沸点最高
C.原子半径X>Y,离子半径X+> Z2—
D.Y的单质和氧化物有相同的晶体类型
参考答案:C
本题解析:略
本题难度:一般
4、填空题 (10分)能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式的简化形式?。
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为?;1 mol C60分子中σ键的数目为?。
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
①第一电离能:As?Se(填“>”、“<”或“=”)。
②二氧化硒分子的空间构型为?。
参考答案:⑴ [Ar]3d84s2?⑵sp2? 90NA?⑶①>?②V形
本题解析:镍28号元素,核外电子排布为[Ar]3d84s2。富勒烯中每个碳原子形成3个δ键,无孤对电子,则价层电子对数=3,sp2杂化。平均每个碳原子有1.5个δ键,所以1molC60含有90NA个δ键。As和Se同主族,Se的电子层多,半径大,所以Se的第一电离能小。SeO2中Se有两对孤对电子,形成了2个δ键,所以价层电子对数=4,VSEPR构型为正四面体,又因为有2对孤对电子,所以空间构型为V型。
点评:价层电子对理论对分析分子构型,原子的杂化方式非常重要。
本题难度:一般
5、填空题 (12分) 已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下 表。
表。
元素
| 结构或性质信息
|
X
| 原子的L层上s电子数等于p电子数。
|
Y
| 原子核外的L层有3个未成对电子。
|
Z
| 在元素周期表的各元素中电负性仅小于氟。
|
Q
| 单质常温、常压下是气体,原子的M层上有1个未成对的p电子。
|
R
| 核电荷数是Y与Q的核电荷数之和
|
E
| 原子序数比R大3
|
请根据信息回答有关问题:
(1)元素Y?的原子核外 共有?种不同运动状态的电子,有?种不同能级的电子。
共有?种不同运动状态的电子,有?种不同能级的电子。
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)?。
(3)X、Z、Q元素均表现最低化合价时的三种氢化 物中,沸点由高到低
物中,沸点由高到低 的排列次序依次为(写化学式)?。
的排列次序依次为(写化学式)?。
(4)R的最高化合价为?。R的一种配合物的化学式为RCl3·6H2O。已知0.01 molRCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是?。
A.[R(H2O)6]C l3? B.[R(H2O)5Cl]Cl2·H2O
l3? B.[R(H2O)5Cl]Cl2·H2O
C. [R(H2O)4Cl2]Cl·2H2O? D.[R(H2O)3Cl3]·3H2O
[R(H2O)4Cl2]Cl·2H2O? D.[R(H2O)3Cl3]·3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3) x Q 2]+,则中心离子为(写化学式)?,配位体为(写化学式)?,x 的值为?。
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不 污染环境,其反应的化学方程式为??。
污染环境,其反应的化学方程式为??。
参考答案:

本题解析:略
本题难度:一般