微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 利用下列实验装置能完成相应实验的是
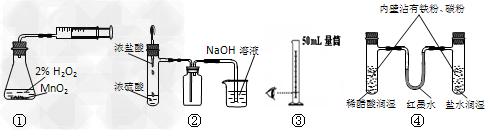
[? ]
A.装置①测定化学反应速率?
B.装置②制取并吸收HCl?
C.装置③量取8.5mL的稀硫酸?
D.装置④模拟铁的腐蚀?
参考答案:D
本题解析:
本题难度:一般
2、简答题 测定硫酸铜晶体(CuSO4?5H2O)里结晶水的含量,实验步骤为:①研磨?②称量空坩埚和装有试样的坩埚的质量?③加热?④冷却?⑤称量?⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1g为止?⑦根据实验数据计算硫酸铜结晶水的含量.
请回答下列问题:
(1)现有坩埚、坩埚钳、三脚架、泥三角、玻璃棒、干燥器、药匙、硫酸铜晶体样品等实验用品,进行该实验时,缺少的实验用品是______.
(2)该实验中哪一步骤需要使用干燥器?使用干燥器的目的是什么?
答:______.
(3)实验步骤⑥的目的是______.
(4)若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有(填入选项的编号):______.
A.被测样品中含有加热不挥发的杂质
B.被测样品中含有加热易挥发的杂质
C.实验前被测样品已有部分失水
D.加热前所用的坩埚未完全干燥.
参考答案:(1)根据个实验步骤,研磨需要研钵;称量需要托盘天平;加热需要酒精灯等.而这些仪器在试题所提供的仪器中并没有出现,故答案为:研钵、托盘天平、酒精灯;
(2)在加热后冷却时,为了防止硫酸铜吸水,应将硫酸铜放在干燥器中进行冷却,从而得到纯净而干燥的无水硫酸铜.
故答案为:冷却;防止吸水;
(3)实验中的加热、冷却、称量的操作步骤要重复进行,直至连续两次称量的差不超过0.1 g为止.这是为了确定样品中结晶水是否已经被全部除去.这样做是为了保证定量实验的准确性.故答案为:检验样品中的结晶水是否已经全部除去;
(4)A、被测样品中含有加热不挥发的杂质会导致测定的水的质量偏小,故A正确;
B、被测样品中含有加热易挥发的杂质会导致测定结果偏大,故B错误;
C、实验前被测样品已有部分失水会导致测定的水的质量偏小,故C正确;
D、加热前所用的坩埚未完全干燥.加热后水挥发,导致水的质量测定结果偏大,故D错误.
故答案为:A、C.
本题解析:
本题难度:一般
3、填空题 有一包白色固体,可能含有NaCl,Na2SO4,BaCl2和Na2CO3中的一种或几种,为探究其成分,某同学做了如下实验:
(1)将此白色固体取样,溶解于水,有白色沉淀生成;
(2)过滤出沉淀,并将沉淀移入试管中,加入稀盐酸,沉淀完全溶解并有气体生成;
(3)向上述滤液中加入硝酸银溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解.
通过上述实验现象分析:该白色固体中一定含有的物质是______,一定不含的物质是______,不能确定的是______.
参考答案:白色固体取样,溶解于水,有白色沉淀生成,则一定含有氯化钡,Na2SO4和BaCl2、Na2CO3和BaCl2反应均可以生成白色沉淀碳酸钡和硫酸钡,其中的碳酸钡可以溶于盐酸而硫酸钡不溶,根据实验②:将①所得沉淀移入试管,加入稀盐酸,沉淀全部溶解并有气体生成,则一定含有Na2CO3,不含Na2SO4,向(1)所得滤液中加入硝酸银溶液,有白色沉淀生成,再加稀硝酸沉淀不溶解,则该沉淀是氯化银,证明含有氯离子,原固体中含有BaCl2;所以氯化钠是否含有不能确定;
综上所述,该白色固体中一定含有的物质是碳酸钠、氯化钡,一定不含的物质是硫酸钠,不能确定的是氯化钠;
故答案为:Na2CO3、BaCl2;Na2SO4;NaCl;
本题解析:
本题难度:一般
4、简答题 三种可溶性物质A、B、C,其中有一种是碱,两种是盐,它们溶于水后电离产生Na+、H+、Ba2+、OH-、CO32-、SO42-六种离子.为鉴别它们,分别完成以下实验.请根据实验的结果回答问题:
(1)A溶液与B溶液反应可生成气体X.根据上述六种离子之间的可能反应判断X的化学式为______,A溶液与B溶液反应的离子方程式为______.
(2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应.则A的化学式为______,B的化学式为______,C的化学式为______.
(3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E.B溶液与C溶液反应至中性的离子方程式为______.
(4)D与E的混合物43g,加入足量盐酸,完全反应生成的气体2.24L(标准状况),则E在混合物中的质量分数为______.
参考答案:(1)生成的气体只有CO2符合,发生的反应为 2H++CO32-=H2O+CO2↑;
故答案为:CO2; 2H++CO32-=H2O+CO2↑;
(2)CO2气体可以和C溶液反应生成沉淀D,则C为Ba(OH)2,沉淀D为BaCO3,与B溶液反应,则B为NaHSO4,所以A为Na2CO3,在溶液中完全电离生成Na+、H+和SO42-,电离方程式为NaHSO4=Na++H++SO42-,检验SO42-时,取B溶液少量,先加盐酸,无明显现象,再加BaCl2溶液产生白色沉淀,
故答案为:Na2CO3,NaHSO4,Ba(OH)2;
(3)B为NaHSO4,C为Ba(OH)2,B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E为BaSO4,B溶液与C溶液反应至中性的离子方程式为:
2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓,
故答案为:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓;
(4)D为BaCO3与E为BaSO4的混合物43g,加入足量盐酸,发生的反应为BaCO3+2HCl=CO2↑+BaCl2+H2O,生成二氧化碳物质的量
n(CO2)=2.24L22.4L/mol=0.1mol,
n(BaCO3)=n(CO2)=0.1mol,
m(BaCO3)=0.1mol×197g/mol=19.7g,
m(BaSO4)=43g-19.7g=23.3g,
所以:w(BaSO4)=23.3g43g×100%=54.18%,
故答案为:54.18%;
本题解析:
本题难度:一般
5、简答题 某化学学习小组的同学设计实验来探究草酸受热分解的产物,他们将草酸受热分解得到的气体通过如下图所示装置:
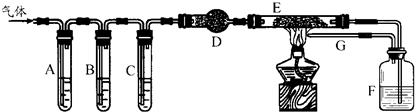
A、C、F中盛装澄清石灰水,B中盛NaOH溶液,E中装有CuO.请填写下列空白:
(1)证明产物中有CO2的现象是______,证明产物中有CO的现象是______.
(2)导管G的作用是______.
(3)小李同学查阅相关资料发现:草酸是二元酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物.小李通过进一步研究认为:草酸蒸气与石灰水反应生成草酸钙白色沉淀,对实验有干扰,因此需要在装置A之前增加一个装有______(填写下列编号字母)的洗气装置.
a.水?b.NaOH溶液?c.Na2CO3溶液?d.饱和NaHCO3溶液
(4)如果在E管中盛装CuO和Cu2O的混合物,根据F瓶增重可以测定混合物中CuO的质量.当CuO和Cu2O的混合物7.6?g全部被还原后,F装置增重3.3?g,混合物中CuO的质量为______?g;当原混合物质量为a?g,反应后F装置增重b?g时,b的取值范围是(用含a的代数式表达)______.
参考答案:(1)草酸受热分解产物中,证明产物中有CO2的现象是装置A中澄清石灰水变浑浊,一氧化碳具有还原性,能将氧化铜还原为金属铜自身被氧化为二氧化碳,如果装置C中澄清石灰水不变浑浊,装置E中黑色固体变为红色,装置F中澄清石灰水变浑浊,可以证明草酸受热分解产物中存在二氧化碳,故答案为:装置A中澄清石灰水变浑浊;装置C中澄清石灰水不变浑浊,装置E中黑色固体变为红色,装置F中澄清石灰水变浑浊;
(2)一氧化碳的尾气处理可以采用点燃法,所以导管G的作用是处理尾气,防止剧毒的CO污染空气,故答案为:处理尾气,防止剧毒的CO污染空气;
(3)草酸分解的气体中含有CO2,用氢氧化钠溶液会将二氧化碳除去,无法进行下一步检验,故b错,草酸既然是酸,那么就会跟碳酸根、碳酸氢根发生反应放出CO2,对检验CO2产生干扰,故c、d错,故选a;
(4)设反应物中CuO为x mol,Cu2O为ymol,混合物7.6g得到产物CO23.3g,根据方程式CuO+CO?△?.?CO2+Cu,
Cu2O+CO?△?.?CO2+2Cu,可列方程组:80x+144y=7.6;(x+y)×44=3.3
? 解得x=0.05,y=0.025,所以CuO质量为:0.05mol×80g/mol=4.0g,根据化学反应,假设原反应物全为CuO,则得CO2为44a80g,假设原反应物全为Cu2O,得CO2为44a144,b的取值范围是:11来源:91exam .orga36<b<11a20,故答案为:4.0; 11a36<b<11a20.
本题解析:
本题难度:一般