微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 钠米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂.
(1)工业上二氧化钛的制备是:
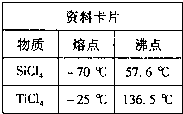
I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4.
II.将SiCl4分离,得到纯净的TiCl4.?
III.在TiCl4中加水、加热,水解得到沉淀TiO2?xH2O.
IV.TiO2?Xh2O高温分解得到TiO2.
①TiCl4与SiCl4在常温下的状态是______.II中所采取的操作名称是______.
②III中反应的化学方程式是______.
IV在实验室完成,应将TiO2?xH2O放在______(填仪器编号)中加热.
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O,其过程大致如下:
a.O2→2O?b.2O+H2O→2OH(羟基)?c.OH+OH→H2O2
①b中破坏的是______(填“极性共价键”或“非极性共价键”).
②H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的______(填“氧化性”或“还原性”).
(3)某研究小组用下列装置模拟“生态马路”部分原理.(夹持装置已略去)

①如缓通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重11g,则CO的转化率为______.
②当CO气体全部通入后,还要通一会儿空气,其目的是______.
参考答案:(1)①根据资料卡片中的TiCl4与SiCl4熔点、沸点可知,TiCl4与SiCl4在常温下的状态是液态;分离沸点相差较大的互溶液体常采取蒸馏方法,
故答案为:液态;蒸馏;
②由信息可知TiCl4与水在加热条件下,水解得到沉淀TiO2?xH2O与HCl,反应方程式为:TiCl4+(x+2)H2O ?△?.?TiO2?xH2O↓+4HCl,
Ⅳ为烧杯与蒸发皿通常进行液态加热,高温分解固体物质常在坩埚中进行,
故答案为:TiCl4+(x+2)H2O ?△?.?TiO2?xH2O↓+4HCl;b;
(2)①由2O+H2O→2OH,可知水中O-H键断裂,O-H键属于极性共价键,故答案为:极性共价键;
②CxHy、CO等具有还原性,H2O2具有强氧化性,H2O2能氧化CxHy、CO等,清除路面空气中的CxHy、CO等,故答案为:氧化性;
(3)①22.4L(已折算成标准状况)CO气体的物质的量为 22.4L22.4L/mol=1mol;
NaOH溶液增重11g为吸收的CO2质量,根据碳元素守恒可知,转化率的CO的物质的量等于CO2的物质的量为 11g44g/mol=0.25mol;
所以CO的转化率为0.25mol1mol×100%=25%,故答案为:25%;
②装置中有残留的CO2气体,通一会儿空气,将残留在装置中的CO2气体排出,被NaOH溶液吸收,减小误差,
故答案为:将残留在装置中的CO2气体排出,被NaOH溶液吸收,减小误差.
本题解析:
本题难度:一般
2、选择题 下列说法正确的是( )
A.当7.8g?Na2O2与H2O完全反应时,有0.2mol电子发生了转移
B.FeCl2溶液与K3[Fe(CN)6]溶液混合后得到特征蓝色沉淀,利用此反应可检验Fe2+
C.用浓盐酸酸化KMnO4溶液以增强其氧化性
D.在3NO2+H2O=2HNO3+NO中,氧化剂和还原剂的质量比为2:1
参考答案:A.n(Na2O2)=7.8g78g/mol=0.1mol,反应中O的化合价由-1价变为-2价、0价,转移的电子为0.1mol,故A错误;
B.FeCl2溶液与K3[Fe(CN)6]溶液混合后发生3FeCl2+2K3[Fe(CN)6]=6KCl+Fe3[Fe(CN)6]2↓,溶液由浅绿色生成蓝色沉淀,可检验,故B正确;
C.盐酸与高锰酸钾发生氧化还原反应,导致高锰酸钾变质,故C错误;
D.在3NO2+H2O=2HNO3+NO中,氧化剂和还原剂的质量比为1:2,故D错误.
故选B.
本题解析:
本题难度:一般
3、填空题 氮气的电子式为______,通常情况下,氮气很不活泼,但在一定条件下可与氧气或氢气反应,请写出这两个反应的方程式:
①氮气作还原剂______;
②氮气作氧化剂______.
参考答案:氮气的电子式为

,故答案为:

;
①氮气与氧气的反应为N2+O2?放电?.?2NO,N元素的化合价升高,作还原剂,故答案为:N2+O2?放电?.?2NO;
②氮气与氢气的反应为N2+3H2催化剂.高温高压2NH3,N元素的化合价降低,作氧化剂,故答案为:N2+3H2催化剂.高温高压2NH3.
本题解析:
本题难度:一般
4、选择题 已知实验室检验Mn2+的方法是用铋酸钠在酸性环境下与锰离子反应,其离子方程式为:2Mn2++5NaBiO3+14H+═2MnO4-+5Na++7H2O+5口下列说法中不正确的是( )
A.NaBiO3是可溶性的盐,可完全电离
B.MnO4-是氧化产物
C.口内粒子为Bi3+,是还原产物
D.NaBiO3在酸性环境下具有强氧化性
参考答案:A、离子方程式中书写可知NaBiO3是可溶性的盐,但不可完全电离,故A错误;
B、锰元素化合价升高,做还原剂被氧化为MnO4-,故B正确;
C、依据离子方程式中的原子守恒,口内粒子为Bi3+,化合价从+5价降低为+3价,是还原产物,故C正确;
D、根据化合价的变化可知铋元素化合价降低做氧化剂,NaBiO3在酸性环境下具有强氧化性,故D正确;
故选A.
本题解析:
本题难度:简单
5、填空题 油画所用颜料含有某种白色铅化合物,置于空气中,天长日久后会变成黑色PbS,从而使油画的色彩变暗,若用H2O2清洗,则可将PbS转变为白色的PbSO4,从而使油画“复原”,H2O2被还原为H2O
(1)上述“清洗”反应的化学方程式为____________
(2)在此反应中,转移的电子数目是__________
(3)用双线桥表示电子转移的情况_______________
参考答案:(1)由PbS转变为白色的PbSO4,H2O2被还原为H2O,PbS作还原剂,H2O2作氧化剂,则发生的氧化还原反应为PbS+4H2O2═PbSO4+4H2O,故答案为:PbS+4H2O2═PbSO4+4H2O;
(2)由反应可知,S元素的化合价由-2价升高到+6价,则化合价变化为6-(-2)=8,即转移的电子数目为8e-,故答案为:8e-;
(3)S元素的化合价由-2价升高到+6价,氧元素的化合价由-1降低为-2,则双线桥表示电子转移的情况为
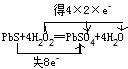 ,故答案为:
,故答案为:
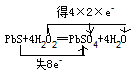
本题解析:
本题难度:一般