微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知在t℃,某Ba(OH)2稀溶液中,c(H+) = 10-a mol·L-1、c(OH-) = 10-b mol·L-1,且a+b=16。向该溶液中逐滴加入pH = c的盐酸,t℃下测得混合液的pH如下图所示
序号
| Ba(OH)2溶液体积/mL
| 盐酸体积/mL
| 混合液pH
|
1
| 22.00
| 0
| 10
|
2
| 22.00
| 18.00
| 9
|
3
| 22.00
| 22.00
| 8
|
假设混合时体积变化忽略不计,则c为
A、3? B、4? C、5? D、6
参考答案:D
本题解析:由题意可知该温度下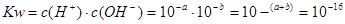 ,即当溶液的PH=8时,该溶液为中性,所以,可由第三组数据求得c=6;
,即当溶液的PH=8时,该溶液为中性,所以,可由第三组数据求得c=6;
本题难度:一般
2、填空题 水是宝贵资源,研究生活和工业用水的处理有重要意义。请回答下列问题:
(1)已知水的电离平衡曲线如图所示。A、B、C三点水的电离平衡常数KA、KB、KC关系为?,若从B点到D点,可采用的措施是 ?(填序号)。
?(填序号)。
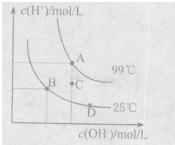
a。加入少量盐酸?
b.加人少量碳酸钠
c.加人少量氢氧化钠
d.降低温度?
(2)饮用水中的NO3-主要来自于NH4+。已知在微生物的作用下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
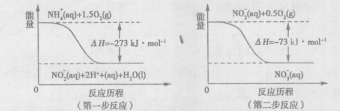
1 molNH4+全部被氧化成NO3-的热化学方程式为?。
(3)某工厂用电解法除去废水中含有的Cr2O72-,总反应方程式为:
Cr2O72-+6Fe+17H2O+2H+?2Cr(OH)3↓+6Fe(OH)3↓+6H2↑,该电解反应的负极材料反应的电极式为?,若有9 mol电子发生转移,则生成的cr(OH)3物质的量为?。
(4)废水中的N、P元素是造成水体富营养化的主要因素,农药厂排放的废水中。常含有较多的NH4+和PO43-,其中一种方法是:在废水中加人镁矿工业废水,可以生成高品位的磷矿石——鸟粪石,反应的离子方程式为Mg2++NH4++PO43-?MgNH4PO4↓。该方法中需要控制污水的pH为7.5—10,若pH高于l0.7,鸟粪石产量会降;低,其原因可能是?。
参考答案:
本题解析:略
本题难度:一般
3、选择题 常温下,下列离子能使纯水中的H+离子数目增加的是?(?)
A.S2-
B.CO32-
C.NH4+
D.Br-
参考答案:C
本题解析:A、S2-水溶液中水解,结合氢离子形成弱酸根离子,促进水的电离氢氧根离子增多,氢离子减少,故A不符合;
B、CO32-水溶液中水解,结合氢离子形成弱酸根离子,促进水的电离氢氧根离子增多,氢离子减少,故B不符合;
C、NH4+水溶液中水解,结合水电离出的氢氧根离子形成弱电解质,氢原子氢离子增多,故C符合;
D、Br-对水的电离无影响,氢离子浓度不变,故D不符合;
故选C。
点评:本题考查了影响水的电离的影响因素,电离平衡的移动方向的判断,主要是盐类水解的应用。
本题难度:一般
4、选择题 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如下图所示,下列判断正确的是
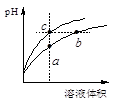
A.a、c两点溶液的导电能力相同
B.b点溶液中c(H+)+c(NH3·H2O)=c(OH-)
C.a、b、c三点溶液水的电离程度a>b>c
D.与等体积b、c处溶液反应,消耗等量的NaOH
参考答案:C
本题解析:盐酸溶液中的氢离子主要是盐酸电离出来的,盐酸完全电离,体积和pH都相同的盐酸和氯化铵溶液加水稀释的过程中,盐酸不能继续电离,盐酸溶液中氢离子浓度变化大;水解是微弱的,氯化铵溶液中铵离子可水解,溶液中的氢离子浓度变化小,所以含c点的曲线pH变化是盐酸溶液的,含a、b点的曲线pH变化是氯化铵溶液的。A、溶液的导电能力和溶液中自由移动离子的多少有关,当溶液的体积相等时,a、c两点溶液的离子浓度不一样,所以导电能力不一样,故A错误;B、b点溶液中,根据质子守恒,得出c(OH-)+c(NH3·H2O)=c(H+),故B错误;C、盐酸电离出的氢离子浓度抑制了水的电离,所以c点溶液中水的电离程度最小;水解促进水的电离,由于氯化铵溶液中的氢离子浓度来自于铵根离子水解生成的氢离子,氢离子浓度越大,说明水解程度越大,水的电离程度越大,a点的pH<b点的pH,说明a点酸性大于b点酸性、a点氢离子大于b点氢离子,所以a、b二点溶液水的电离程度a>b,综上所述a、b、c三点溶液水的电离程度a>b>c,故C正确;D、用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb<Vc,故D错误,答案选C。
本题难度:一般
5、实验题 (11分)氧化还原滴定法是科研和生产中测定溶液中物质浓度的常用方法。
⑴莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银滴定待测液,进而测定溶液中Cl-的浓度 [Ksp(AgCl) =1.56×10-10,Ksp(Ag2CrO4)=1.10×10-12,Ag2CrO4为砖红色]
①滴定终点的现象是_________________;
②硝酸银标准液应装在 ?式滴定管中滴定。
③已知该滴定适宜的酸度范围是pH 6.5~10.5,但当溶液中有铵盐存在,c(NH4+)<0.05mol/L时,应将溶液的pH控制在6.5~7.2。下列有关说法你认为合理的有__________。
a.若溶液pH<6.5,则Cr2O72—+H2O 2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
b.若溶液中有铵盐存在时,当pH>7.2,则有可能因为生成[Ag(NH3)2]+,影响实验结果
c.滴定时应剧烈摇动,以使被AgCl沉淀吸附的Cl-?及时释放出来,防止滴定终点提前
⑵氧化还原滴定是水环境监测常用的方法,可用于测定废水中的化学耗氧量(单位:mg/L——每升水样中还原性物质被氧化需O2的质量)。某废水样100.00mL,用硫酸酸化后,加入0.01667mol/L的K2Cr2O7溶液25.00mL,使水样中的还原性物质在一定条件下完全被氧化。然后用0.1000mol/L的FeSO4标准溶液滴定剩余的Cr2O72-,实验数据记录如下:
 ?实验数据 ?实验数据
实验序号
| FeSO4溶液体积读数/mL
|
滴定前
| 滴定后
|
第一次
| 0.10
| 16.20
|
第二次
| 0.30
| 15.31
|
第三次
| 0.20
| 15.19
|
①完成离子方程式的配平:
___Cr2O72-+___Fe2++____? _______ ??____Cr3++____Fe3++____H2O?
②计算废水样的化学耗氧量。 (写出计算过程,结果精确到小数点后一位。)
参考答案:⑴①滴入最后一滴标准溶液,生成砖红色沉淀(1分)② 酸式(1分)③abc(3分)
⑵①1、6、14H+?、2、 6、 7(2分)
② 分析实验数据记录表,第一次实验数据有误,故剔除这一数据。?
消耗的FeSO4标准溶液平均体积为:[ (15.31-0.30)+(15.19-0.20)]/2=15.00mL?(1分)
则废水中消耗的K2Cr2O7总物质的量为: 0.01667mol/L×0.025L -1/6×15.00×10-3L×0.1000mol/L=1.667×10-4mol=0.1667mmol(1分)
据2K2Cr2O7~3 O2可知,废水中化学耗氧量m(O2)= (0.1667mmol×1.5×32g/mol)÷0.1000L=80.0mg/L
本题解析:K2CrO4为指示剂,Ag2CrO4为砖红色,用标准硝酸银滴定待测液,滴定终点的现象是滴入最后一滴标准溶液,生成砖红色沉淀;硝酸银标准液应装在酸式滴定管;已知该滴定适宜的酸度范围是pH 6.5~10.5,但当溶液中有铵盐存在,c(NH4+)<0.05mol/L时,应将溶液的pH控制在6.5~7.2。a.若溶液pH<6.5,则Cr2O72—+H2O 2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
2CrO42—+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
b.若溶液中有铵盐存在时,当pH>7.2,则有可能因为生成[Ag(NH3)2]+,影响实验结果
c.滴定时应剧烈摇动,以使被AgCl沉淀吸附的Cl-?及时释放出来,防止滴定终点提前。都合理。用硫酸酸化后,加入0.01667mol/L的K2Cr2O7溶液25.00mL,使水样中的还原性物质在一定条件下完全被氧化,所以,氢离子是反应物,水是生成物。根据 化合价升高降低一致可得该离子方程式是:
_1__Cr2O72-+__6_Fe2++___14_? __H+_____ = ___2_Cr3++_6___Fe3++___7_H2O?
点评:在氧化还原滴定中,往往需要在滴定之前,先将被测组分氧化或还原到一定的价态,然后进行滴定。这一步骤称为预先氧化或还原处理。通常要求预处理时所用的氧化剂或还原剂与被测物质的反应进行完全,反应快,过量的试剂容易除去,并要求反应具有一定的选择性。
本题难度:一般