微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 ⅤA族的氮、磷、砷(As)、锑(Sb)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在科研和生产中有许多重要用途。请回答下列问题:
(1)N、P、As原子的第一电离能由大到小的顺序为?(用元素符号表示)。
(2)As原子核外M层电子的排布式为?。
(3)叠氮化钠(NaN3)用于汽车安全气囊中氮气的发生剂,写出与N互为等电子体的分子的化学式?(任写一种即可)。
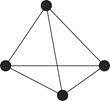
图1
(4)白磷(P4)的结构如图1所示,P原子的轨道杂化方式是?。
(5)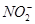 可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
①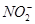 的立体构型是?。
的立体构型是?。
②在K3[Co(NO2)6]中,中心离子的配位数为?。
(6)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸(HOCH2CHCOOHNH2)。判断丝氨酸是否存在手性异构体??(填“是”或“否”)。
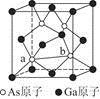
图2
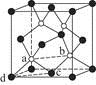
(7)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图2所示,其晶胞边长为cpm,则密度为?g·cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为?pm(用含c的式子表示)。
参考答案:(1)N>P>As
(2)3s23p63d10
(3)CO2或CS2或N2O(任写一种,写成SiO2等原子晶体形式不正确)
(4)sp3
(5)①V形或角形或折线形
②6
(6)是
(7)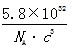 ,?
,?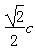 (说明:如图所示,平行四边形abcd中ab=cd=
(说明:如图所示,平行四边形abcd中ab=cd=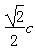 )
)
本题解析:(1)同一主族元素的原子半径越大,越易失去电子,电离能越小。(3)等电子体指原子总数相等,价电子总数相等的粒子。(4)白磷分子中每个P原子有一个孤电子对,形成了3个σ键,故采取sp3杂化。(5)NO中氮原子的孤电子对数为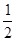 ×(5+1-2×2)=1,与O原子形成了2个σ键,采取sp2杂化,
×(5+1-2×2)=1,与O原子形成了2个σ键,采取sp2杂化,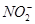 为角形。(6)丝氨酸中连接氨基的碳原子上连接的四个原子或原子团均不相同,该碳原子为手性碳原子。(7)每个晶胞中含有砷原子个数4个,镓原子个数为8×
为角形。(6)丝氨酸中连接氨基的碳原子上连接的四个原子或原子团均不相同,该碳原子为手性碳原子。(7)每个晶胞中含有砷原子个数4个,镓原子个数为8×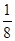 +6×
+6×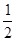 =4,则晶体密度为
=4,则晶体密度为 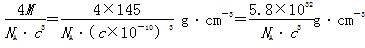
本题难度:一般
2、选择题 科学家最近发现2种粒子:第1种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第2种是由四个氧原子构成的分子.下列有关这两种粒子的说法不正确的是( )
A.“四中子”不显电性
B.“四中子”的质量数为4
C.第2种粒子是氧元素的另一种同位素
D.第2种粒子的化学式为O4
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列分子中,属于非极性分子的是( )
①SO2 ②BeCl2 ③BBr3 ④COCl2.
A.①②
B.②③
C.③④
D.①④
参考答案:①SO2分子中S元素的最外层电子数为6,化合价为+4,最外层电子未全部成键,是极性分子,故①错误;
②BeCl2分子中Be元素的最外层电子数为2,化合价为+2,最外层电子全部成键,是非极性分子,故②正确;
③BBr3分子中B元素的最外层电子数为3,化合价为+3,最外层电子全部成键,是非极性分子,故③正确;④COCl2中心C原子成2个C-Cl键、1个C=O,不含孤电子对,为平面三角形,分子不对称,为极性分子,故④错误.
故选B.
本题解析:
本题难度:简单
4、选择题 下列说法中,正确的是( ? )
A.非金属元素组成的单质中一定含有共价键
B.非金属元素的气态氢化物中一定含有共价键
C.离子化合物中一定不含有共价键
D.一种化合物中只能含有一种化学键
参考答案:B
本题解析:
本题难度:简单
5、选择题 下列各分子中所有原子都满足最外层为8电子结构的是
[? ]
A.BeCl2
B.PCl3
C.PCl5
D.H2
参考答案:B
本题解析:
本题难度:简单