微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。?

⑴某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
[观察外观] 该硫酸铵化肥无可见机械杂质。
[实验探究]按下图所示装置进行实验。
①烧瓶内发生反应的离子方程式为:___________________。烧杯中盛放的试剂最好是______(填“浓硫酸”、 “稀硫酸”或“水”)
②实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是____________。
[交流讨论]
③甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:____________;
④乙同学:实验装置中还存在另一个明显缺陷是:______________;经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验。
[探究结论]
⑤称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4 g。则该化肥_________(填“是”或“不是”)一等品。

⑵某工厂用石膏、NH3、H2O、CO2制备(NH4)2SO4,首先石膏磨成粉末制成CaSO4悬浊液,然后按如下工艺流程进行产生:
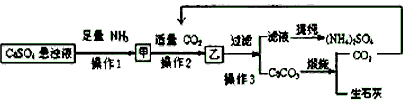
①操作1与操作2的顺序能否调换?______(填能与否),理由是______。
②常温下,CaCO3和CaSO4的溶解度分别为1.5×10-3g和2.1×10-1g,请解析CaSO4向CaCO3转化的原因。________________。
③ 从绿色化学角度考虑,该工艺流程应增加一个操作,这个操作是________________。
参考答案:(1)①NH4++OH- NH3
NH3 +H2O; 稀硫酸
+H2O; 稀硫酸
②使NH4+完全反应,并使NH3从溶液中溢出
③产生的氨气中带有水蒸汽,A、B间缺少一个干燥装置
④烧瓶和导管中有氨气残留,不能完全被稀硫酸吸收
⑤不是
(2)①否;氨气在水中的溶解度大,产量高
②由于CaCO3溶解度小,Ca2+更易与CO32-结合生成沉淀,促使CaSO4溶解
③用生石灰制备CaSO4
本题解析:
本题难度:一般
2、填空题 (15分)
(1)某化学兴趣小组的同学进行Cl2、NH3的制备、性质等实验的流程和部分装置如下:
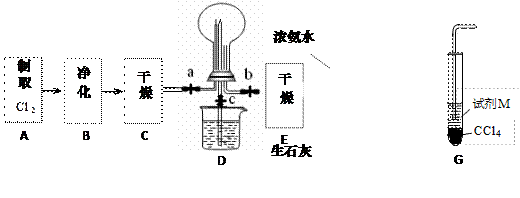
①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2 的氧化性强弱为Cl2>Fe3+>I2(实验中不断小心振荡G装置中的试管)。请回答A中发生反应的离子方程式?,试剂M为?溶液,证明氧化性为Cl2>Fe3+>I2的 实验现象是?;
②已知3Cl2 +2 NH3 =" 6HCl" + N2 ,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b ,D中的现象为?,反应一段时间后,关闭b打开c,观察到的现象为?;
③为使实验顺利进行,请简述F中的分液漏斗的正确操作方法 ?;
(2)某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-离子的浓度,设计如下实验方案:
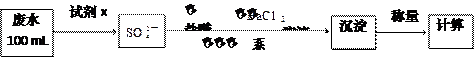
①从下列试剂中选择试剂x为 (填序号):
A.0.1 mol·L-1 KMnO4(H2SO4酸化)溶液? ? B.0.5 mol·L-1 1NaOH溶液?
? C.新制氯水 D.KI溶液
②加入试剂x生成SO42-的离子方程式为 ? ?;
③第ⅲ步的“系列操作”包含的操作名称为? 、 、? ??;
④证明该废水中是否含有CO32-的实验方案为?。
参考答案:(1)①  (2分),FeI2(1分),先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色(1分)
(2分),FeI2(1分),先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色(1分)
②黄绿色气体消失,产生白烟(1分),烧杯中的液体进入烧瓶中,形成喷泉(1分)
③将F装置中分液漏斗顶端的塞子打开,再打开分液漏斗的旋塞,使分液漏斗中的液体流下(1分)。?
(2)①C(1分);
②Cl2+SO32-+H2O = 2Cl-+SO42-+2 H+(2分);
③ 过滤、洗涤、干燥(2分,少写1种扣1分,少写2种不得分);
④向废水中加入足量的盐酸(1分),将生成的气体先通入足量的 酸性KMnO4溶液,
通入澄清石灰水(1分),若紫色KMnO4溶液颜色变浅,石灰水变浑浊,则证明废水中
含有CO32-(1分)(若只加入盐酸没有使用氧化剂,则只能得1分)
本题解析:略
本题难度:一般
3、选择题 利用下列试剂,选用合适方法鉴别Na2SO4、Na2SO3、Na2CO3、NaCl四种溶液,最佳试剂组是( )
A.BaCl2、HCl、石蕊溶液
B.BaCl2、HCl、品红溶液
C.AgNO3和HNO3溶液
D.AgNO3和BaCl2溶液
参考答案:A.加入BaCl2溶液分别生成BaSO4、BaSO3、BaCO3沉淀,BaSO3和BaCO3溶于盐酸,并且BaSO3与盐酸反应生成刺激性气味的SO2气体,而BaCO3与盐酸反应无色无味的CO2,SO2和CO2都能是石蕊试液变红,鉴别效果不好,故A错误;
B.在Na2SO4、Na2SO3、Na2CO3、NaCl中滴加BaCl2和HCl.Na2SO4生成沉淀不溶解;NaCl不生成沉淀;Na2SO3、Na2CO3生成沉淀后都溶解,但Na2SO3生成的气体可以使品红褪色,而Na2CO3不能,可鉴别,故B正确;
C.加入AgNO3和HNO3溶液,Na2SO3被氧化为Na2SO4,不能鉴别,故C错误;
D.加入AgNO3和BaCl2溶液,都生成白色沉淀,不能鉴别,故D错误.
故选B.
本题解析:
本题难度:简单
4、实验题 固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用下图装置(夹持装置略)对其进行探究实验。

(1)仪器B的名称是________。
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为________;Ⅳ中发生反应的化学方程式为________;V中的试剂为________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ?Ⅲ?Ⅳ?Ⅱ?V?Ⅵ,此时Ⅱ中现象为________,原因是________。
(4)经上述反应,2.5 g化合物A理论上可制得0.56 L(标准状况)M,则A的化学式为________。
参考答案:(1)分液漏斗 (2)碱石灰;3CuO+2NH3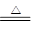 3Cu+N2+3H2O;浓H2SO4 (3)试纸变蓝;氧化铜与氨气反应生成的水和未反应的氨气形成氨水,使红色石蕊试纸变蓝
3Cu+N2+3H2O;浓H2SO4 (3)试纸变蓝;氧化铜与氨气反应生成的水和未反应的氨气形成氨水,使红色石蕊试纸变蓝
(4)Mg3N2
本题解析:(1)带有活塞的漏斗是分液漏斗。(2)根据实验流程图可知,用红色石蕊试纸检验的是氨气,氨气是一种碱性气体,用碱石灰干燥氨气;氨气具有还原性,可将黑色的CuO还原为红色的Cu,自身被氧化为N2;尾气中的氨气被浓硫酸吸收,最后N2用排水法收集。(3)氧化铜与氨气反应生成的水和未反应的氨气形成氨水,使红色石蕊试纸变蓝。
(4)0.56 L M即N2的物质的量为0.025 mol,则化合物A中N的质量为0.7 g,则另一种元素的质量为1.8 g,经过对A中未知元素的化合价讨论可得,只能是+2价的Mg,故该物质是Mg3N2。
本题难度:一般
5、实验题 某校化学兴趣小组设计了如下实验装置(图中部分夹持仪器已略去)来测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应。

请回答下列问题:
(1)mg铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现彖,其原因是①_____②_____
(2)点燃酒精灯,可观察到B中的现象是_____________________,C 的作用是___________________
(3)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为________________(写表达式)。
(4)兴趣小组使用设计的如图实验装置,操作正确,且每一个反应均完全,仍然发现所测得的铁碳合金中铁的质量分数偏低,其主要原因是________________。
(5)若反应一段时间后,用滴管吸取A中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
I:只含有Fe3+; II:只含有Fe2+;III:________________________
验证III的实验方法是________________________
参考答案:
(1)常温下碳与浓硫酸不反应,常温下Fe遇浓硫酸发生钝化
(2)品红溶液褪色,或“颜色变浅”;除尽反应产物中的SO2气体
(3)(11m-3b)/11m
(4)干燥管中的碱石灰吸收了空气中的二氧化碳、水蒸气等
(5)既有Fe2+又有Fe3+
取试样少许于试管中,先滴加少量的KSCN溶液,振荡后溶液显红色证明有Fe3+;再取试样少许于另一支试管中,滴加少量的酸性KMnO4溶液,若浅红色褪去,证明溶液中含有Fe2+。
本题解析:(1)常温下,碳与浓硫酸不反应,Fe遇浓硫酸发生钝化,因此无明显现象。
(2)点燃酒精灯后,反应开始,碳与浓硫酸反应可生成CO2和SO2,Fe与浓硫酸反应生成SO2,B装置检验SO2,现象是品红褪色,C装置除尽SO2,D装置干燥气体,E装置吸收CO2。
(3)E增重的是CO2的质量,bgCO2中C的质量为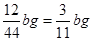 ,因此Fe的质量分数为
,因此Fe的质量分数为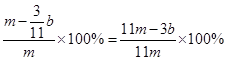 。
。
(4)该实验的原理是通过测量CO2的量计算铁的质量分数,CO2的质量通过干燥管E的实验前后质量差获得,干燥管右侧直接通空气,则空气中的CO2、水蒸气都可能进入干燥管中,使CO2的质量偏大,铁的质量分数偏小。
(5)结合前两种可能,则第三种是既有Fe2+又有Fe3+。检验Fe3+一般用KSCN,现象是溶液显红色,检验Fe2+一般利用其还原性,用酸性KMnO4溶液检验,现象是浅红色褪去。
本题难度:困难