| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《化学基本概念》考点巩固(2017年最新版)(十)
参考答案:A 本题解析:元素处在最低价态只有还原性。只有Cl-处在最低价。答案选A。 本题难度:一般 2、选择题 下列说法不正确的是 |
参考答案:D
本题解析:A、复分解反应中各元素的化合价都不发生变化,所以一定不是氧化还原反应,A正确;B、单质变为化合物或化合物变为单质,一定有电子的转移,所以一定是氧化还原反应,B正确;C、有单质参加的化合反应,一定有元素化合价的变化,所以一定是氧化还原反应,C正确;D、没有单质生成的分解反应也可以是氧化还原反应,如NH4NO3 = N2O↑ + 2H2O,D错误;答案选D。
考点:考查氧化还原反应与四种基本反应类型的关系。
本题难度:一般
3、选择题 三氟化氮 是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关该反应的说法正确的是
是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关该反应的说法正确的是
A.NF3是氧化剂,H2O是还原剂
B.NF3在潮湿空气中泄漏会看到红棕色气体
C.每消耗0.2mol氧化剂,可收集到5.418L气体
D.若生成1molHNO3,则转移NA个电子
参考答案:B
本题解析:A.在反应中NF3中的N在反应后化合价既升高,也降低,因此既是氧化剂也是还原剂,而水中元素的化合价没有变化,所以H2O只是反应物,错误;B.NF3在潮湿空气中泄漏,与水反应产生的NO与氧气会发生反应产生NO2而使气体呈红棕色,正确;C.根据方程式可知:每消耗0.2mol氧化剂,可收集到1.1mol的气体,由于不知道外界条件,所以不能确定气体的体积,错误;D.若生成1molHNO3,则转移2NA个电子,错误。
考点:考查氧化还原反应中的电子转移、化合价的升降及概念的辨析的知识。
本题难度:困难
4、填空题 (10分)现有下列七种物质:①铝 ②蔗糖③CO2④H2SO4⑤Ba(OH)2⑥红褐色的氢氧化铁胶体⑦HCl
(1)上述物质中属于电解质的有________。(填序号)
(2)向⑥的溶液中逐渐滴加⑦的溶液,看到的现象是 。
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为:H++OH-====H2O,则该反应的化学方程式为__________________________________________。
(4)⑦的浓溶液与高锰酸钾发生反应的化学方程式为:2KMnO4+16HCl(浓)="===" 2MnCl2+2KCl+5Cl2↑+8H2O,该反应中的氧化剂是_______,氧化产物是 。
参考答案:(1)④、⑤、⑦ (2)开始产生红褐色沉淀,后来沉淀溶解消失 (3)Ba(OH)2+2HCl==BaCl2+2H2O
(4)KMnO4 Cl2
本题解析:(1)根据电解质的概念:在水溶液中或熔融状态下能导电的化合物,所以电解质一定是化合物,属于纯净物,自身能电离出离子。①铝是单质,错,②蔗糖不能电离出离子,错,③CO2不能电离出离子,④H2SO4符合条件,对,⑤Ba(OH)2符合条件,对,⑥红褐色的氢氧化铁胶体是混合物,错,⑦HCl符合条件,对,所以属于电解质的有④、⑤、⑦;(2) 胶体中加入电解质溶液,先发生聚沉,盐酸较多的时候,氢氧化铁与盐酸反应,沉淀消失。(3)反应能用 H++OH- = H2O 表示则是强酸和强碱反应,没有沉淀生成,所以是盐酸和Ba(OH)2反应,方程式为Ba(OH)2+2HCl = BaCl2+2H2O。(4)氧化剂中的元素化合价降低,KMnO4中的Mn从+7降低到+2,所以氧化剂是KMnO4,氧化产物是由还原剂被氧化生成的,Cl2是氧化产物。
考点:电解质的概念,基本化学反应和氧化还原反应的概念。
本题难度:一般
5、填空题 (10分)在KClO3+6 H Cl(浓)=KCl+3Cl2↑+3H2O的反应中,氧化剂是___________,还原产物是_________,得电子与失电子个数比是____________,氧化产物与还原产物的质量比是________,试标出反应电子转移方向和数目_________________________
参考答案:
KClO3,Cl2, 1∶5, 5∶1, 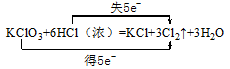
本题解析:该反应中元素的化合价变化如下:KClO3→Cl2 ,氯元素由+5价→0价,,5个电子,被还原,所以KClO3是氧化剂,Cl2是还原产物;H Cl→Cl2,氯元素化合价由-1价→0价,失1个电子,氯元素被氧化,Cl2是氧化产物,根据得失电子守恒,可知得电子与失电子个数比是1∶5,氧化产物与还原产物的质量比是5:1,1moL氯酸钾转移的电子的物质的量是5moL,再根据原子守恒配平方程式.答案为:
KClO3,Cl2, 1∶5, 5∶1, 
考点:考查氧化还原反应的基本概念与电子转移。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《物质的检验.. | |