| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《弱电解质电离平衡》考点巩固(2017年最新版)(八)
参考答案:D 本题解析:A、水溶液导电能力与溶液中的离子浓度有关,强电解质的稀溶液的导电能力也弱,错误;B、熔化状态不导电的不一定是弱电解质,如HCl是强电解质,但熔融状态不导电,错误;C、在水溶液中存在分子的物质不一定是电解质,如蔗糖,错误;D、稀溶液中存在离子与未电离的分子,说明该物质能发生电离,但部分电离,所以是弱电解质,正确,答案选D。 本题难度:一般 2、选择题 下列比较中,正确的是 参考答案:B 本题解析:A、酸性:HF>HCN,故等浓度的NaF溶液中氟离子的水解程度比 NaCN 溶液中CN-的水解程度小,溶液的碱性弱,但二者水解均产生氢氧根,则等浓度等体积的NaF溶液和 NaCN 溶液中阴子总数相等,错误;B、0.2 mol?L-l NH4Cl 和 0.l mol?L-l NaOH 溶液等体积混合后所得溶液为等浓度的氯化铵、氯化钠和一水合氨的混合液,溶液呈碱性,一水合氨的电离程度大于铵离子的水解程度,离子浓度大小关系为:c (Cl-) > c(NH4+)> c (Na+) > c (OH-) >c (H+),正确;C、0.1 mol/L的NaHB溶液pH为4说明HB-的电离程度大于其水解程度,又电离和水解都是微弱的,则有:c(HB-) >c(B2-) >c(H2B),错误;D.氨水中的 NH4+来自弱电解质NH3·H2O的电离,弱电解质的电离的电离是微弱的,其余三者中NH4+来自强电解质盐的电离,铵离子的水解微弱,故相同物质的量浓度的四种溶液中, NH3·H2O中c(NH4+) 最小,错误。 本题难度:困难 3、选择题 把1 L 0.1 mol·L-1醋酸溶液用蒸馏水稀释到10 L,下列叙述正确的是( ) |
参考答案:C
本题解析:对于反应CH3COOH CH3COO-+H+,当加水稀释时,平衡向正反应方向移动,c(CH3COOH)小于原来的,c(H+)大于原来的,A、B项均错误;由于平衡正向移动,n(CH3COO-)增大,n(CH3COOH)减小,所以的比值增大,C项正确;由于CH3COO-和H+的浓度均减小,溶液的导电性减弱,D项错误,故选C。
CH3COO-+H+,当加水稀释时,平衡向正反应方向移动,c(CH3COOH)小于原来的,c(H+)大于原来的,A、B项均错误;由于平衡正向移动,n(CH3COO-)增大,n(CH3COOH)减小,所以的比值增大,C项正确;由于CH3COO-和H+的浓度均减小,溶液的导电性减弱,D项错误,故选C。
考点:弱电解质的电离
本题难度:一般
4、选择题 用水稀释0.1 mol·L-1的CH3COOH溶液,其中随水的量增加而增大的是?
①c(H+) ②n(H+) ③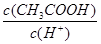 ?④
?④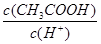 ?⑤c(OH-) ?⑥c(CH3COO-)
?⑤c(OH-) ?⑥c(CH3COO-)
A.①②③
B.②③⑤
C.④⑤
D.④⑤⑥
参考答案:B
本题解析:用水稀释0.1 mol·L-1的CH3COOH溶液,醋酸的电离平衡破坏,平衡正向移动,氢离子的物质的量增大,但是浓度减小,相应的氢氧根离子浓度增大,因此选B。
本题难度:一般
5、选择题 对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是(?)
A.加入适量的氯化铵晶体后,两溶液的pH均碱小
B.温度下降10oC,两溶液的pH均不变
C.分别加水稀释10倍,两溶液的pH仍相等
D.用盐酸中和,消耗的盐酸体积相同
参考答案:A
本题解析:同pH,同体积的弱碱和强碱,加入NH4Cl后,氢氧根均减小;温度降低Kw改变,pH改变。加水稀释十倍,氨水电离程度增加,pH(NH3·H2O)>pH(NaOH),n(NH3·H2O)>n(NaOH),NH3·H2O消耗的盐酸更多。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《物质的组成.. | |