微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.复盐的溶解度一般比组成它的每一种盐都小
B.合金的熔点一般比组成它的每一种金属都高
C.用NaOH溶液和铝盐反应得不到Al(OH)3沉淀,因此一般用氨水与铝盐反应制备
Al(OH)3
D.萃取剂选择的标准之一是不能与被萃取的物质反应,并且密度要比原溶剂大
参考答案:A
本题解析:合金的熔点一般比组分金属低;用氨水制备Al(OH)3是为了防止Al(OH)3溶于过量强碱,并不是不能生成Al(OH)3;萃取剂的密度不必比原溶剂大,只要与溶剂不互溶即可。
本题难度:简单
2、填空题 (16分)下图中的实验装置可用于制取乙炔。请填空:
 ?
?
(1)图中,A管的作用是?。
制取乙炔的化学方程式是?。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是?,乙炔发生了?反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是?,乙炔发生了?反应。
(4)为了安全,点燃乙炔前应?,乙炔燃烧时的实验现象是?。
参考答案:(1)调节水面高度以控制反应的发生与停止;CaC2+2H2O →C2H2↑+ Ca(OH)2?(2)酸性KMnO4溶液褪色;氧化(3)溴的CCl4溶液褪色;加成
(4)检验纯度;火焰明亮并伴有浓烈黑烟、放出热量
本题解析:(1)因为电石与水很剧烈,反应不易控制,所以通过调节水面高度以控制反应的发生与停止,方程式为CaC2+2H2O →C2H2↑+ Ca(OH)2。
(2)乙炔中含有碳碳三键,容易被氧化,所以乙炔可以使酸性高锰酸钾溶液褪色。
(3)同样因为乙炔中含有碳碳三键,容易发生加成反应,所以乙炔可以使溴的CCl4溶液褪色。
(4)乙炔实验可燃性气体,点燃前需要检验其纯度。防止燃烧时爆炸。乙炔中含碳量很高,燃烧时火焰明亮并伴有浓烈黑烟。
本题难度:简单
3、选择题 下列气体中,既能用浓硫酸干燥,又能用碱石灰干燥的是( )
A.CO2
B.N2
C.SO2
D.NH3
参考答案:浓硫酸是酸性物质,所以不能干燥碱性气体;碱石灰是氧化钙和氢氧化钠的混合物,所以碱石灰是碱性物质,不能干燥酸性物质.
A、二氧化碳是酸性物质,能和碱石灰反应,所以不能用碱石灰干燥,故A错误;
B、氮气是中性气体,既不和浓硫酸反应也不和碱石灰反应,所以既能用浓硫酸干燥,又能用碱石灰干燥,故B正确;
C、二氧化硫是酸性物质,能和碱石灰反应,所以不能用碱石灰干燥,故C错误;
D、氨气是碱性气体,能和酸反应,所以不能用浓硫酸干燥,故D错误;
故选B.
本题解析:
本题难度:一般
4、填空题 (8分)铁是人类较早使用的金属之一,根据所学铁及其化合物的知识,回答下列问题:
(1)下列各物质中,不能和单质铝反应的物质是?(填下列各项序号)。
①Fe?②FeCl3?③FeSO4 ?
(2)向沸水中逐滴滴加1mol·L-1FeCl3溶液,至液体呈透明的红褐色,实验得到的分散系
属于?(填“溶液”“浊液”或“胶体”),所得到的分散系中的分散质具有的性质有如下的?(填写序号)。
①电泳?②透过半透膜?③聚沉?④具有强还原性
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的化学方程式:?;证明反应后的溶液中存在Fe3+的实验方法是?。
参考答案:(共8分)?(1) (1分)①? (2) (3分)胶体(1分)①③(2分)
(3) (4分)2FeCl3 + Cu = 2FeCl2 + CuCl2(2分);取试样少许滴入硫氰酸钾溶液,溶液显红色,证明溶液中含有Fe3+(2分)(其它答案合理则同样得分)
本题解析:(1)铝是活泼的金属,且金属性强于铁的,所以铝能和氯化铁,以及氯化亚铁都反应,铁和铝不反应,答案选①。
(2)向沸水中逐滴滴加1mol·L-1FeCl3溶液,至液体呈透明的红褐色,所得到的分散系是胶体,胶体具有电泳现象、能发生聚沉,但氢氧化铁胶体不能透过半透膜、没有强还原性,答案选①③。
(3)氯化铁能和铜反应,生成氯化铜和氯化亚铁,反应的化学方程式是2FeCl3 + Cu = 2FeCl2 + CuCl2。检验铁离子常用试剂是KSCN溶液,即取试样少许滴入硫氰酸钾溶液,溶液显红色,证明溶液中含有Fe3+。
点评:该题是高考中的常见题型,所以注重基础性知识的考查,同时兼顾考查学生分析问题、解决问题的能力。有助于培养学生的逻辑思维能力和发散思维能力,以及严格的规范答题能力。
本题难度:一般
5、填空题 (12分)高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备路线如下:

试回答下列问题
(1)操作①搅拌的目的是:?。
(2)操作②与操作③相同,该操作名称是:___________________。
(3)反应器中,NaOH、NaClO及Fe(NO3)3反应的离子方程式为: _______________________。
(4)次氯酸钠浓度对高铁酸钾产率有一定影响,当高铁酸钾产率最高时,NaClO的物质的量浓度约为_________。(计算结果保留一位小数)
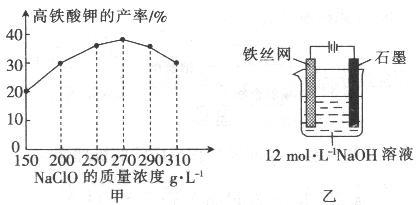 ?
?
(5)从环境保护的角度看,制备中间产物Na2FeO4较好的方法为电化学法,其装置如图乙所示,则阳极的电极反应式为?。
参考答案:(1)为了加速反应物之间的接触,加快化学反应速率。(2分)
(2)过滤(2分)
(3)2Fe3+ + 3ClO─ + 10OH─ ="=" 2FeO42─ + 3Cl─ + 5H2O(3分)
(4)3.6mol/L(2分)
(5)Fe + 8OH─ ─6e─ ="=" FeO42─ + 4H2O(3分)
本题解析:略
本题难度:简单