微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)AlCl3溶液加热蒸干后灼烧所得固体是___________
(2)Al2(SO4)3溶液加热蒸干所得固体是_________ Al2(SO4)3水解的离子方程式为____________ 。
参考答案:(1)Al2O3?
(2) Al2(SO4)3?; Al3++3H2O  Al(OH)3+3H+
Al(OH)3+3H+
本题解析:
本题难度:一般
2、选择题 Al和Al2O3的混合物15g,加入稀H2SO4150mL,在标准状况下放出氢气1.68L,Al和Al2O3均不剩余,为中和过量的硫酸,并使溶液中Al3+恰好完全转化为Al(OH)3沉淀,需要消耗3mol·L-1NaOH溶液200mL,则该稀硫酸的物质的量浓度为(?)
A.2.25 mol·L-1
B.2 mol·L-1
C.0.3 mol·L-1
D.0.6 mol·L-1
参考答案:B
本题解析:
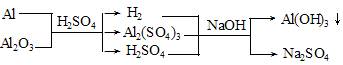
根据最终溶液中的电荷守恒和化学反应中的质量守恒可得:
n(H2SO4)=n(Na2SO4)=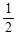 n(NaOH)=
n(NaOH)=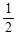 ×3mol·
×3mol·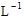 ×0.2L=0.3 mol
×0.2L=0.3 mol
所以c(H2SO4)=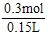 =2 mol·L-1。
=2 mol·L-1。
本题难度:简单
3、选择题 在含1mol KAl(SO4)2的溶液中逐滴加入2mol Ba(OH)2溶液,下列有关说法中正确的是
A.先生成沉淀,后沉淀全部溶解
B.当溶液中Al3+全部沉淀出来时,沉淀的总物质的量最大
C.最后得到的沉淀是BaSO4
D.最后的沉淀为2mol BaSO4、1mol Al(OH)?3
参考答案:AC
本题解析:KAl(SO4)2的电离方程式为:KAl(SO4)2=K++AL3++2SO42-;1mol KAl(SO4)2中含K+1mol,AL3+1mol,SO42-2mol,当逐滴加入Ba(OH)2溶液时,立即有AL(OH)3沉淀和BaSO4沉淀生成,当加入的Ba(OH)2的物质的量达到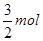 时,AL3+全部生成AL(OH)3沉淀,其物质的量为1mol;BaSO4的物质的量为
时,AL3+全部生成AL(OH)3沉淀,其物质的量为1mol;BaSO4的物质的量为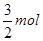 ;再加入
;再加入 Ba(OH)2溶液时,又有
Ba(OH)2溶液时,又有 ?BaSO4生成,而AL(OH)3沉淀则全部恰好溶解生成ALO2-。即此时沉淀的质量达到最大。所以,正确的选项只有C。A错,沉淀最后为BaSO4;B错,当AL3+全部生成ALO2-沉淀的质量最大;
?BaSO4生成,而AL(OH)3沉淀则全部恰好溶解生成ALO2-。即此时沉淀的质量达到最大。所以,正确的选项只有C。A错,沉淀最后为BaSO4;B错,当AL3+全部生成ALO2-沉淀的质量最大;
本题难度:一般
4、选择题 十九世纪中期,铝的价格十分昂贵,甚至超过了当时黄金的价格.这是因为( )
A.铝的制备比较困难
B.铝是很稳定的金属
C.铝元素在自然界的含量很少
D.铝的用途太多
参考答案:A、十九世纪中期,金属铝的制取还没有合理的方法,制取困难加之量少,导致价格过高,故A正确;
B、金属铝的化学性质不稳定,易在表面形成一层氧化膜,故B错误;
C、金属铝在自然界中排第三位,含量不少,故C错误;
D、金属铝的用途广不是制约金属铝价格贵的原因,生产厂家多,则生产的量可以多,关键是制备比较困难,故D错误.
故选A.
本题解析:
本题难度:简单
5、选择题 下列叙述中所描述的物质一定是金属元素的是( ?)
A.易失去电子的物质
B.原子最外层只有一个电子的元素
C.单质具有金属光泽的元素
D.第3周期中,原子最外电子层只有2个电子的元素
参考答案:D
本题解析:A中H不符合,B中可能为H,C中可能为石墨,均不符合题干要求。
本题难度:简单