微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法不正确的是( )
A.使用分光光度计,可以换算得到某溶液的浓度
B.pH试纸是将试纸用多种酸碱指示剂的混合液浸透,经晾干后制成的
C.在滴定过程中,滴加溶液的速度不能太快,一般以每秒3~4滴为宜
D.移液管管尖残留的液体一定要用洗耳球吹出以保证移取液体体积的准确性
参考答案:A.分光光度计采用一个可以产生多个波长的光源,通过系列分光装置,从而产生特定波长的光源,光线透过测试的样品后,部分光线被吸收,计算样品的吸光值,从而转化成样品的浓度.样品的吸光值与样品的浓度成正比,故A正确;
B.pH试纸上有甲基红、溴甲酚绿、百里酚蓝这三种指示剂.甲基红、溴甲酚绿、百里酚蓝和酚酞一样,在不同PH值的溶液中均会按一定规律变色,故B正确;
C.在滴定过程中,滴加溶液的速度一般以每秒3~4滴为宜,故C正确;
D.移液管是用来准确移取一定体积的溶液的量器,移液管是一种量出式仪器,只用来测量它所放出溶液的体积. 所以移液管管尖残留的液体不能用洗耳球吹出,否则量取的体积就偏大,故D错误.
故选D.
本题解析:
本题难度:一般
2、选择题 对含微量I-的某样品进行I-化学定量测定,有以下两种途径,最后均是以淀粉作指示剂,用Na2S2O3标准溶液滴定以求得I-的浓度。下列分析正确的是
已知:5I-+IO3-+6H+=3H2O+3I2? I-+3Br2(过量)+3H2O=6H++6Br-+IO3-
方法一I-(样品) IO3-
IO3-
 I2
I2 I-
I-
方法二I-(样品) I2
I2 I-
I-
A.方法二对样品所做处理操作简便,用作微量的测定更准确
B.当待测液由无色变为蓝色时即达到滴定终点
C.方法一与方法二测量出的样品浓度比为6:l
D.假设各步骤操作均得当,方法一所消耗Na2S2O3标准溶液的体积是方法二的6倍
参考答案:D
本题解析: A、很难控制使Br2恰好反应,错误;B、当待测液由蓝色变为无色时即达到滴定终点,错误;C、方法一与方法二测量出的样品浓度比为1:l,错误;D、假设各步骤操作均得当,方法一中的碘单质量是方法二中的6被,所消耗Na2S2O3标准溶液的体积与方法二的6倍,正确。
本题难度:一般
3、选择题 某实验小组配制了0.2 mol·L-1的NaOH的溶液备用,下列保存方法正确的是(? )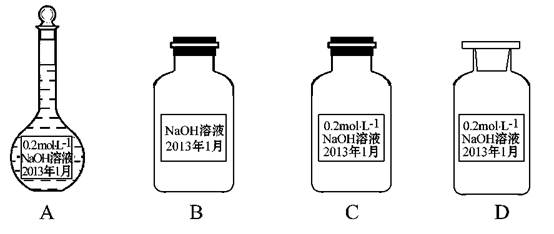
参考答案:C
本题解析:A选项容量瓶不能用于保存,错误。B选项溶液保存应使用细口瓶,错误。D选项应使用橡皮塞,错误。
本题难度:一般
4、填空题 (安徽省合肥八中2008—2009学年度高三第二次月考,化学,18)用6mol·L-1的硫酸配制100mL1.0mol·L-1硫酸,若实验仪器有:
A.100mL量筒? B.托盘天平? C.玻璃棒? D.50mL容量瓶
E.20mL量筒? F.胶头滴管? G.50mL烧杯? H.100mL容量瓶
(1)实验时应选用仪器的先后顺序是(填入编号)?。
(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)?。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2cm~3cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近容量瓶刻度标线1cm~2cm处,用滴管滴加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
(3)怎样检查容量瓶是否漏水?。
参考答案:(1)G、E、C、H、F或E、G、C、H、F;(2)B、C、D;(3)将瓶塞打开,加入少量水,塞好瓶塞,倒转,不漏水,然后正放,把瓶塞旋转180°再倒转不漏水,则说明该容量瓶瓶塞严密。
本题解析:(1)依据用6mol·L-1的硫酸配制100mL1.0mol·L-1硫酸溶液步骤为:计算(16.7mL6mol·L-1的硫酸溶液)→量取(20mL量筒)→溶解(烧杯、玻璃棒)→冷却到室温→转移(100mL容量瓶)→洗涤→振荡摇匀→定容(胶头滴管)→振荡摇匀,故所选仪器先后顺序为G、E、C、H、F或E、G、C、H、F;(2)B中容量瓶用蒸馏水洗净后,不用待配溶液润洗,C、D中不能在容量瓶溶解固体物质或稀释浓溶液;(3)容量瓶检漏方法为:将瓶塞打开,加入少量水,塞好瓶塞,倒转,不漏水,然后正放,把瓶塞旋转180°再倒转不漏水,则说明该容量瓶瓶塞严密。
本题难度:简单
5、填空题 (10分)(1)玻璃棒是中学化学实验中常用的仪器。下列实验过程中,一般不需要用玻璃棒的是?(填写编号)
①粗盐提纯?
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
⑤实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
(2)①读取滴定管中滴体体积时,仰视液面,读取的体积数?实际体积数(填“>”、“=”或“<”)
②用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,所称取食盐的质量为?g。
③实验需用480mL 0.1mol·L-1NaOH溶液,配制溶液时除需用胶头滴管、烧杯、托盘天平(带砝码)、玻璃棒、药匙外,还必需用到的仪器是?,所称取NaOH固体的质量为?g。
参考答案:(1)③⑤?(2)① >?② 9.6?③ 500ml容量瓶? 2.0
本题解析:(1)玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、引流,①粗盐提纯的操作过程是溶解、过滤、蒸发,溶解用玻璃棒搅拌加速溶解,过滤需用玻璃棒引流,蒸发须用玻璃棒搅拌防止液体中局部过热,需要;②配制一定物质的量浓度的氯化钠溶液,溶解时用到烧杯、玻璃棒,玻璃棒的作用是搅拌,加速固体溶解,向容量瓶中转移液体用玻璃棒引流,需要;③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体,为防止胶体聚沉不能用玻璃棒搅拌,不需要;④探究Ba(OH)2?8H2O晶体和NH4Cl晶体反应过程中的能量变化,需用玻璃棒搅拌让它们充分混合,加快反应速率,需要;⑤实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀,该反应速率快,为防止氢氧化亚铁被氧化不能用玻璃棒搅拌,不需要;选③⑤;(2)①滴定管的零刻度在上面,越往下刻度越大,仰视液面读数体积偏大,所读的刻度大于实际的刻度大;②根据左盘的质量=右盘的质量+游码的质量,所以药品质量=砝码质量-游码质量;某同学用托盘天平称量食盐时,药品、砝码放颠倒称得的结果是10.4g(1g以下用游码),即食盐的实际质量为10.0g-0.4g=9.6g,;③一定容积的容量瓶只能配制相应体积的溶液,根据容量瓶的规格选择,实验室没有480ml容量瓶,应选择500ml容量瓶,实际配制溶液500ml,需配制500ml?0.1mol/L的NaOH溶液,需要氢氧化钠的物质的量为:0.5×0.1mol/L=0.05mol,故需要氢氧化钠的质量为0.05mol×40g/mol=2.0g。
本题难度:一般