微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 如下图所示,若电解5 min,铜电极质量增加2.16 g。试回答:
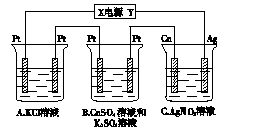 ?
?
(1)电极X是电源的?极。
(2) pH变化:A?,B?,C?。
(3)若A中KCl溶液的体积为200 mL,电解至5 min,溶液的pH是?(假设溶液体积不变化)。
参考答案:(1)负? (2)增大减小不变? (3) 13
本题解析:(1)由铜电极质量增加可知铜电极为阴极,进一步可推知X是电源的负极。(2)A电解的方程式为2KCl+2H2O H2↑+Cl2↑+2KOH,A溶液pH增大;B电解的方程式为2CuSO4+2H2O
H2↑+Cl2↑+2KOH,A溶液pH增大;B电解的方程式为2CuSO4+2H2O 2Cu+O2↑+2H2SO4,B溶液pH减小;C是电镀池,C溶液pH不变。(3)根据电子得失守恒得如下关系式:2KCl+2H2O
2Cu+O2↑+2H2SO4,B溶液pH减小;C是电镀池,C溶液pH不变。(3)根据电子得失守恒得如下关系式:2KCl+2H2O H2↑+Cl2↑+2KOH~2e-~2Ag,由铜极上析出Ag的质量可计算出A中生成的KOH的物质的量,进而即可计算出A溶液的pH。
H2↑+Cl2↑+2KOH~2e-~2Ag,由铜极上析出Ag的质量可计算出A中生成的KOH的物质的量,进而即可计算出A溶液的pH。
本题难度:简单
2、填空题 (14分)理论上讲,任何自发的氧化还原反应都可以设计成原电池。某同学利用 “Cu+2Ag+ =2 Ag +Cu2+ ” 反应设制一个化学电池,如图所示,已知该电池在外电路中,电流从a极流向b极。请回答下列问题:
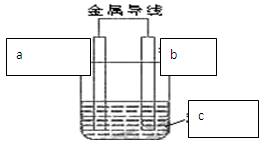
(1)b极是电池的?极,材料是?,该极上出现的现象是?,写出该电极的反应式?。
(2)a可能为?
A、铜? B、银? C、铁 D、石墨
(3)c溶液是?
A、CuSO4溶液? B、AgNO3溶液? C、酒精溶液
(4)若该反应过程中有0.2mol电子发生转移,则生成Ag为?克。
参考答案:(1)负、Cu、铜片逐渐溶解,溶液变蓝色、Cu – 2e-? =? Cu2+
(2) BD?(3)B?(4)21.6
本题解析:由Cu+2Ag+ =2 Ag +Cu2+知,铜失电子,Cu – 2e-? =? Cu2+,做负极,不断溶解。正极材料应为比铜活性差的电极。
本题难度:简单
3、选择题 用石墨作电极,分别电解下列各物质的溶液①CuCl2? ②CuSO4 ③NaBr ④NaNO3?⑤盐酸 ⑥H2SO4 ⑦KOH。其中只有水被电解的有 ( )
A.①②⑤
B.③④⑥⑦
C.④⑥⑦
D.③⑤⑥⑦
参考答案:C
本题解析:惰性电极电解氯化铜溶液,电解的是氯化铜。电解硫酸铜溶液,电解的是铜离子和水。电解溴化钠,放电的离子是Br-和H+。电解硝酸钠放电的是氢离子和OH-,实质电解水。电解盐酸,放电的离子是氢离子和氯离子;惰性电极电解硫酸和氢氧化钾溶液,放电的离子是氢离子和OH-,实质电解水,答案选C。
点评:在判断电解产物时,首先判断阳极电极材料。如果是活性电极,则电极本身失去电子。如果是惰性电极,则溶液中的阴离子失去电子。而阴极是溶液中的阳离子得到电子,所以需要熟练记住常见离子的放电顺序。
本题难度:一般
4、选择题 电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH—==IO3—+5I—+3H2O
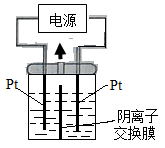
下列说法不正确的是
A.右侧发生的电极方程式:2H2O+2e—==H2↑+2OH—
B.电解结束时,右侧溶液中含有IO3—
C.电解槽内发生反应的总化学方程式KI+3H2O======KIO3+3H2↑
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
参考答案:D
本题解析:用阴离子交换膜时,电解的电极反应为:
阳极: 2I——2e—="=" I2?左侧溶液变蓝色
3I2+6OH—==IO3—+5I—+3H2O?一段时间后,蓝色变浅
阴极:? 2H2O+2e—==H2↑+2OH—?右侧放出氢气
如果用阳离子交换膜代替阴离子交换膜:
通过阳离子交换膜,电极反应为:
阳极:2I——2e—="=" I2?多余K+
阴极:2H2O+2e—==H2↑+2OH—?保证两边溶液呈电中性
考查电化学相关知识,涉及到了电极反应方程式书写,正负极判断等。
本题难度:一般
5、选择题 将0.2molAgNO3、0.4molCu(NO3)2、0.6molKCl溶于水,配成100mL溶液,用惰性电极电解一段时间后,若在一极析出0.3molCu,此时在另一极上产生的气体体积(标准状况)为(?)
A.4.48L
B.5.6L
C.6.72L
D.7.84L
参考答案:C
本题解析:由Ag++Cl-=AgCl↓可知,0.2molAg+和0.2molCl-沉淀;
在阴极上有0.3molCu2+放电: Cu2++2e-=Cu,转移电子为0.6mol;
在阳极上先有0.6mol-0.2mol=0.4mol的Cl-放电:2Cl--2e-=Cl2↑,生成氯气0.2mol;然后为保证电子的得失守恒,又有0.2mol的OH-放电:4OH--4e-=2H2O+O2↑,生成0.05mol氧气,共生成0.25mol气体,体积为6.72升
答案为C
本题难度:一般