微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学 化学知识回答下列问题:
化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序___。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)____________________________________。
(3)浓度为0.1mol/L的(NH4)2Fe(SO4)2溶液与(1)相比c(NH4+)?中的大(填化学式)
参考答案:
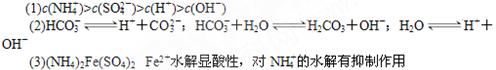
本题解析:略
本题难度:一般
2、选择题 分析以下几个热化学方程式,能表示氢气燃烧热的热化学方程式是
A.H2(g)+1/2O2(g)===H2O(g)ΔH =—a1 kJ/mol
B.H2(g)+CuO(s)===Cu+H2O(l)ΔH =-a2 kJ/mol
C.2H2(g)+O2(g)===2H2O(l)ΔH =-a3 kJ/mol
D.H2(g)+1/2O2(g)===H2O(l)ΔH =-a4 kJ/mol
参考答案:D
本题解析:燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,排除BC;
水对应的稳定的氧化物为液太,排除A;
答案为D
本题难度:简单
3、选择题 常温下,某溶液中由水电离出来的c(OH-)=1×10—11 mol/L,若向该溶液中滴入2—3滴酚酞,溶液的颜色可能是?(?)
mol/L,若向该溶液中滴入2—3滴酚酞,溶液的颜色可能是?(?)
A.只显红色
B.呈无色
C.无色或粉红
D.红色或无色
参考答案:D
本题解析:略
本题难度:一般
4、选择题 下列说法正确的是?
A.某水溶液中只要c(H+)=c(OH-),则一定是中性的
B.纯水中c(H+)与c(OH-)的乘积一定等于1×10-14
C.温度升高水的电离程度增大,pH值增大
D.电离程度大的酸一定比电离程度小的酸pH值小
参考答案:A
本题解析:某水溶液中只要c(H+)=c(OH-),则一定是中性的,故A正确;只有在常温下,纯水中c(H+)与c(OH-)的乘积才等于1×10-14,故B错误;温度升高水的电离程度增大,pH值减小,故C错误;电离程度大的酸一定比电离程度小的酸pH值小,这种说法是错误的,因为没有指定浓度。
点评:本题考查了化学术语,属于对基础知识的考查,本题比较溶液,注意的是水中c(H+)与c(OH-)的乘积才等于1×10-14。
本题难度:一般
5、填空题 实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定氢氧化钠的质量分数约为82%,为了验证其纯度,用浓度为0.2 mol·L-1的盐酸进行滴定,完成下列问题:
(1)称取5.0 g该氢氧化钠固体样品,配成500 mL溶液备用。
(2)将标准盐酸装在25.00 mL的________滴定管中,调节液面位置在“0”刻度以下,并记录下刻度。
(3)取20.00 mL待测液。该项实验操作使用的主要仪器有________。用酚酞作指示剂时,滴定到溶液颜色由________色刚好变成________色为止。
(4)滴定达终点后,记下盐酸用去20.00 mL,计算氢氧化钠的质量分数为________。
(5)试分析上述滴定误差可能由下列哪些实验操作引起________(填序号)。
A.转移待测液至容量瓶时,未洗涤烧杯
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸
C.滴定时反应器摇动太激烈,有少量液体溅出
D.滴定到终点时,滴定管尖嘴悬有气泡