微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用图中示意的两套仪器装置,制取上述铁的氧化物(左)和“引火铁”(右)。实验中必须使用普通铁粉和6mol/L盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热 设备等在图中均已略去)。
设备等在图中均已略去)。
填写下列空白:
⑴实验进行时试管A中应加入的试剂是______;
烧瓶B的作用是____________________;
在试管D中收集得到的是_______________。
⑵实验时,U型管G中应加入的试剂是____________;
长颈漏斗H中应加入___________。
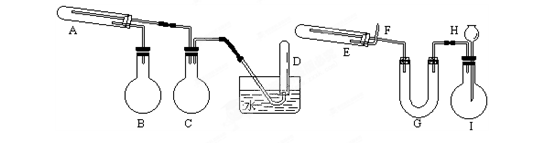 ⑶两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)__________。
⑶两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)__________。
⑷试管E中发生反应的化学方程式是_______________。
⑸为了安全,在E管中的反应发生前,在F 出口处必须_____________________。
出口处必须_____________________。
参考答案:

本题解析:略
本题难度:一般
2、选择题 将a mol纯铁粉投入含HNO3b mol的稀溶液里,恰好完全反应并放出 NO气体,则a和b的关系是?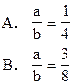
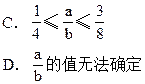
参考答案:C
本题解析:Fe和稀HNO3可按下列两式反应:
当a∶b=3∶8时,3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
当a∶b=1∶4时,Fe+4HNO3=Fe(NO3)3+NO↑+2H2O

本题难度:一般
3、选择题 向盛有硫酸铜溶液的试管中滴加氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应前后Cu2+的浓度不变
B.沉淀溶解后,将生成深蓝色的配离子[Cu(NH3)4]2+
C.向反应后的溶液中加入乙醇,溶液无明显变化
D.在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道
参考答案:B
本题解析:略
本题难度:简单
4、填空题 某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺,其设计的流程如下:

回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式?;
(2)“酸溶”中反应的离子方程式为?;
(3)“过滤”后滤液中金属阳离子有?;
(4)“氧化”中使用的氧化剂最好是?;
(5)该工艺流程中产生的SO2会污染空气并形成酸雨,下列物质:①BaCl2②品红③石灰乳 ④O2,用于吸收SO2最好的是?。
参考答案:(1)3FeS2+8O2 Fe3O4+6SO2;(没配平扣1分,无高温不扣分。)?
Fe3O4+6SO2;(没配平扣1分,无高温不扣分。)?
(2)Fe3O4+8H+=2Fe3++Fe2++4H2O;(没配平扣1分,多写其它的离子方程式既不给分也不扣分。)
(3)Fe3+、Fe2+(各1分); (4)Cl2(H2O2等只要合理也可);(5)③
本题解析:(1)由题意可知硫铁矿中铁被氧化成了Fe3O4,可知反应式为3FeS2+8O2 Fe3O4+6SO2 ;
Fe3O4+6SO2 ;
(2)Fe3O4可溶解于盐酸中,反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O ;
(3)由Fe3O4的组成可知铁的化合价为+2和+3;
(4)氧化剂的加入是为了把其中的+2铁氧化成+3,只要不引入杂质即可,如Cl2、O3、H2O2 均可;
(5)吸收尾气SO2 工业上一般用碱性物质,如石灰乳。
本题难度:一般
5、选择题 铜的冶炼大致可分为:
(1)富集,将硫化物矿进行浮选;?
(2)焙烧,主要反应为2Cu+FeS2+4O2 Cu2S+3SO2+2FeO(炉渣);
Cu2S+3SO2+2FeO(炉渣);
(3)制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2 2Cu2O+2SO2,2Cu2O+Cu2S
2Cu2O+2SO2,2Cu2O+Cu2S 6Cu+SO2;
6Cu+SO2;
(4)电解精炼。
下列说法正确的是( )?
A.上述灼烧过程的尾气均可直接排到空气中?
B.由6 mol CuFeS2生成6 mol Cu,上述共消耗15 mol O2?
C.在反应2Cu2O+Cu2S 6Cu+SO2中,作氧化剂的只有Cu2O
6Cu+SO2中,作氧化剂的只有Cu2O
D.电解精炼时,粗铜应与外电源正极相连?
参考答案:BD
本题解析:由于灼烧产生的SO2直接排放到大气中会造成大气污染,所以A项错误;根据上述反应可知每产生1 mol铜需要消耗2.5 mol氧气,所以B项正确;在反应2Cu2O+Cu2S 6Cu+SO2中,作氧化剂的有氧化亚铜和硫化亚铜。
6Cu+SO2中,作氧化剂的有氧化亚铜和硫化亚铜。
本题难度:一般