微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某学习小组在研究水处理问题时,将一定量NaClO溶液与FeSO4溶液相混合,得到含有大量悬浮物的混合液。请完成对反应物剩余情况的探究。
(1)提出合理假设:
假设1:FeSO4有剩余;
假设2:NaClO有剩余;
假设3:__________________。
(2)样品初步处理:取少量混合液于试管中,滴加足量稀硫酸得到澄清溶液。此澄清溶液中肯定含有的金属阳离子是___________。
(3)设计后续实验方案验证假设。请在答题卡上写出实验步骤以及预期现象和结论。 限选实验试剂:
3mol/L H2SO4、0. 01 mol/L KMnO4、20% KSCN、3% H2O2、淀粉-KI溶液、紫色石蕊溶液。

2、选择题 下列装置或操作能达到实验目的的是
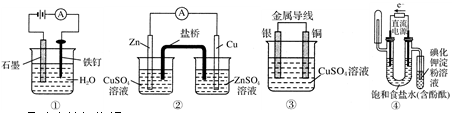
A.①防止铁钉生锈
B.②构成铜锌原电池
C.③构成铜银原电池
D.④验证NaCl溶液(含酚酞)电解产物
3、实验题 在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
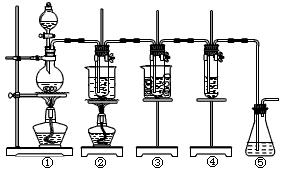
图中:
①为氯气发生装置;
②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;
③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;
④的试管里加有紫色石蕊试液;
⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
(A)碱石灰 (B)饱和食盐水 (C)浓硫酸 (D)饱和碳酸氢钠溶液
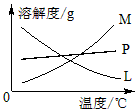
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:___________________。反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
(3)本实验中制取次氯酸钠的离子方程式是________________________。
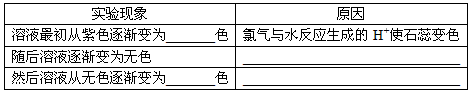
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白
4、实验题 (11分)下图是实验室加热氯酸钾和高锰酸钾的混合物制取和收集氧气的装置图
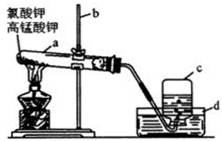
⑴指出图中有标号的仪器名称:
? a:_______ b:_______ c:_______ d:_______
⑵实验时应注意:①实验前要检查装置的_______性,其
方法是_____?__。
②试管口要___?____,其目的是_____?__。
③给试管加热时__?_____。④停止加热时,先要____?___,然后___?____。
5、实验题 (16分)某同学为测定黄铜矿的纯度(主要成分CuFeS2含少量SiO2),设计如下实验:称取2.0g研细的该黄铜矿样品,高温下和空气中的氧气充分反应:
 ? 6CuFeS2+19O2
? 6CuFeS2+19O2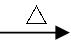 6CuO+2Fe3O4+12SO2
6CuO+2Fe3O4+12SO2
生成的SO2进入D中和水发生反应:SO2+H2O=H2SO3;
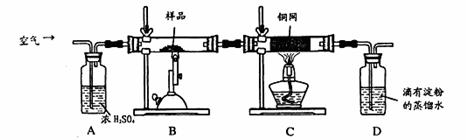
(1)称量该样品时用的仪器的名称为?。
(2)装置A的作用?;
a.有利于空气中氧 气充分反应? b.除去空气中的水份
气充分反应? b.除去空气中的水份
c.有利于气体混合? d.有利于观察空气流速
(3)装置B中反应结束后,仍需继续通一段时间空气的目的?。
(4)实验后将D中的溶液全部转移至锥形瓶,用1.0mol/L的I2溶液进行滴定,反应为:H2SO3+I2 +H2O=H2SO4+2HI,达到终点时消耗I2溶液20.00mL,判断滴定达到终点的现象为?,通过计算,该黄铜矿的纯度为?(Cu:64? Fe:56? S:32)
+H2O=H2SO4+2HI,达到终点时消耗I2溶液20.00mL,判断滴定达到终点的现象为?,通过计算,该黄铜矿的纯度为?(Cu:64? Fe:56? S:32)