微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 锰锌干电池在放电时,电池总反应方程式可以表示为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O.在此电池放电时,正极(碳棒)上发生反应的物质是( )
A.Zn
B.碳
C.MnO2和NH4+
D.Zn和NH3
参考答案:锰锌干电池在放电时,发生Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O,
Zn元素的化合价升高,失去电子,作负极,
则正极(碳棒)上,Mn元素的化合价降低,所以MnO2得到电子发生还原反应,只有C符合,
故选C.
本题解析:
本题难度:一般
2、填空题 (本题6分)依据某氧化还原反应设计的原电池如图所示。
(1)该氧化还原反应的离子方程式为_________________________________。
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出铜片和银片洗净干燥后称重,总质量为67.6g,请计算:通过导线的电子的物质的量。(要求有计算过程)
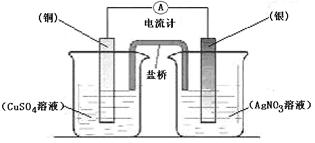
参考答案:(1)2Ag++Cu =Cu2++2Ag ;(2)解:设导线中转移电子x mol
2Ag++Cu =Cu2++2Ag △m 转移e-
(2×108
本题解析:
本题难度:一般
3、简答题 利用碳棒、锌片和200ml稀硫酸组成原电池,将化学能转化为电能,当碳棒上共产生3.36L(标准状况)气体时,硫酸恰好全部被消耗.试计算:
(1)有多少个电子通过了导线.
(2)原稀硫酸溶液的物质的量浓度.
参考答案:(1)Zn+H2SO4 =ZnSO4 +H2↑? ?转移电子
? 22.4L?2×6.02×1023个?
? 3.36L? 1.806×1023个?
故答案为:1.806×1023个.
(2)Zn+H2SO4 =ZnSO4 +H2↑?
? ?1mol? 22.4L?
?0.15mol? 3.36L?
C=nV=0.15mol?0.2L=0.75mol/L
故答案为0.75mol/L
本题解析:
本题难度:一般
4、填空题 (10分)铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。放电时,该电池总反应式为:Pb+PbO2+2H2SO4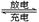 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
(1)该蓄电池的负极材料是_________,放电时发生_________(填“氧化”或“还原”)反应。
(2)该蓄电池放电时,电解质溶液的酸性_________(填“增大”、“减小”或“不变”),电解质溶液中阴离子移向_________(填“正”或“负”)极。
(3)已知硫酸铅为不溶于水的白色沉淀,生成时附着在电极上。试写出该电池放电时,正极的电极反应_______________________________________(用离子方程式表示)。
(4)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为KOH溶液,则氢氧燃料电池的负极反应式为__________________________________。该电池工作时,外电路每流过1×103 mol e-,消耗标况下氧气_________m3。
参考答案:本题共10分
(1)Pb(1分); 氧化(1分)
(2)减小(1分); 负(1分)
(3)PbO2+2 e-+SO2-4+4H+=PbSO4+2H2O(2分)
(4)H2-2e-+2OH-=2H2O(2分); 5.6(2分)
本题解析:(1)该蓄电池的负极发生氧化反应,根据总化学反应方程式可知,Pb作负极,放电时发生氧化反应;
(2)放电时消耗硫酸,生成硫酸铅和水,所以电解质溶液的酸性减小,放电相当于是原电池,所以电解质溶液中的阴离子移向负极;
(3)放电时的正极即是PbO2发生还原反应,得电子与硫酸结合生成硫酸铅,电极反应式为
PbO2+2 e-+SO2-4+4H+=PbSO4+2H2O;
(4)氢氧燃料电池中的电解质溶液若为KOH溶液,则在负极发生氧化反应的氢气,失去电子,与氢氧根离子结合生成水,电极反应式为H2-2e-+2OH-=2H2O,该电池工作时,正极的反应式为O2+4e-+2H2O=4OH-,所以外电路每流过1×103 mol e-,则消耗氧气得物质的量是1000/4=250mol,标准状况下的体积是250mol×22.4L/mol=5600L,合5.6m3。
考点:考查电化学反应原理的应用,电极反应式的书写,氧化还原反应的计算
本题难度:一般
5、选择题 如图所示的装置能形成原电池的是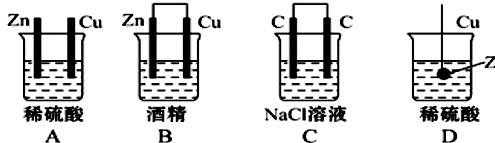
参考答案:D
本题解析:略
本题难度:简单