微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:

(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________(填仪器名称)。
(2)写出加入氯水发生反应的离子方程式_____________________________________。
(3)检验沉淀已经洗涤干净的操作及现象是_____________________。
(4)坩埚质量为W1 g,加热后坩埚与红棕色固体总质量为W2 g,则样品中铁元素的质量分数是________ (列出原始算式,不需化简);若称量准确而最终测量的结果偏大,则造成误差的原因可能是_____________________________________________________________
(写出一种原因即可)。
参考答案:(1)100 mL容量瓶、胶头滴管
(2)2Fe2++Cl2=2Fe3++2Cl-
(3)取少量最后一次洗涤液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净;
(4) ×100% 固体加热时未充分反应变为Fe2O3
×100% 固体加热时未充分反应变为Fe2O3
本题解析:(1)配制100 mL溶液,需用100 mL容量瓶,定容时使用胶头滴管;(2)氯气有强氧化性,能把二价铁离子氧化生成三价铁离子同时生成氯离子,离子方程式为2Fe2++Cl2=2Fe3++2Cl-。(3)检验沉淀已洗涤干净时,取少量最后一次洗涤液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净;(4)红棕色固体是氧化铁,其质量是W2 g-W1 g,其中铁元素的质量是 g,样品中铁元素的质量分数是
g,样品中铁元素的质量分数是 ×100%;固体加热时未充分反应变为Fe2O3会导致测量结果偏大。
×100%;固体加热时未充分反应变为Fe2O3会导致测量结果偏大。
本题难度:一般
2、选择题 下列反应中,观察不到颜色变化的是( )
A.黄色的氯化铁溶液中加入足量铁粉
B.往稀硫酸中通入氨气
C.往品红溶液中通入足量二氧化硫气体
D.一氧化氮气体暴露在空气中
参考答案:B
本题解析:
本题难度:一般
3、选择题 制印刷电路时常用FeCl3溶液作为“腐蚀液”,发生的反应为:2FeCl3+Cu=2FeCl2+CuCl2向盛有FeCl3溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A.有Cu无Fe
B.有Fe无Cu
C.Fe、Cu都有
D.Fe、Cu都无
参考答案:B
本题解析:
本题难度:简单
4、填空题 铁及其化合物有重要用途,如聚合硫酸铁[Fe2(0H)n(S04)3-n/2]m是一种新型高效的水 处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设 计如下方案制备上述两种产品:
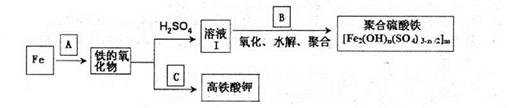
请回答下列问题:
(1)若A为H20(g),可以得到Fe304,写出H2O的电子式:_______.
(2)若B为NaC103与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-):____。
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸鉀的化学方程式 并配平:

(4)为测定溶液I中铁元素的总含量,实验操作:准确量取20.00mL溶液I于带塞锥形瓶 中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1000mol.L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:
①写出滴定选用的指示剂______,滴定终点观察到的现象______:
②溶液丨中轶元素的总含量为______g.L-1。若滴定前溶液中H202没有除尽,所测定的铁元 素的含量将会______ (填“偏高” “偏低” “不变”)。
(5)设计实验方案,检验溶液I中的Fe2+和Fe3+______。
参考答案:
(1)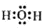
(2)6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
(3)Fe2O3+2KNO3+4KOH  2K2FeO4+3KNO2+2H2O
2K2FeO4+3KNO2+2H2O
(4)①淀粉?溶液由蓝色变为无色且半分钟不变色?②5.6?偏高
(5)取溶液1少量于试管中,加入盐酸酸化,再加入高锰酸钾溶液,溶液颜色从深紫色变成黄色或变浅,则含有Fe2+。或去少量溶液1于试管中,加入铁氰化钾溶液,有蓝色沉淀生成,则含有Fe2+。
本题解析:
(2)酸性条件下,ClO3-氧化Fe2+为Fe3+,本身被还原为Cl-,根据得失电子相等、电荷守恒、质量守恒配平。
(3)缺项物质为K2FeO4和H2O,根据得失电子相等、质量守恒配平。
(4)①Fe3+氧化I-生成I2,淀粉遇碘变蓝,选择淀粉溶液作指示剂;当加入最后一滴硫代硫酸钠溶液时,蓝色消失,且半分钟不变色说明是终点;②由Fe3+~S2O32-得n(Fe3+)=0.002mol,铁元素总含量为5.6g/L;H2O2也能氧化I-生成I2,所以若过氧化氢没有除尽,则消耗硫代硫酸钠溶液体积偏大,所测结果偏高。
(5)检验溶液中的Fe3+可用KSCN溶液。检验溶液中的Fe2+可用酸性高锰酸钾溶液或K3[Fe(CN)]6溶液。
本题难度:一般
5、选择题 向Fe2O3、CuO、Fe、Cu的混和粉末中加入过量的稀盐酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是( )
A.只有Fe2+和Cu2+
B.一定有Fe2+、Cu2+,可能有Fe3+
C.一定有Fe2+,可能有Cu2+
D.只有Fe2+
参考答案:A.当铜全部析出时,不存在Cu2+,故A错误;
B.由于红色粉末是Cu,所以溶液当中肯定没有Fe3+,故B错误;
C.由于氧化性:Fe3+>Cu2+,无论是和Fe反应,还是和Cu反应,溶液中一定存在Fe2+,当Fe过量时,不存在Cu2+,当Fe不足时,有Cu2+,故C正确;
D.由C分析可知,溶液中可能还有Cu2+,故D错误.
故选C.
本题解析:
本题难度:简单