微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、判断题 锂电池由于其安全可靠的性能,体积小、质量轻、高效能及可逆等卓越品质被广泛应用于移动电话、笔记本电脑、数码相机等便携式电子器材中。下图为锂电池工作原理图,阴极材料由LiMO2(M=Co,Ni,V,Mn)构成,阳极材料由石墨构成,阴、阳两极之间用半透膜隔开,充电时锂离子由阴极向阳极迁移,放电时则相反,电池可表示为:
(-)Cn/LiClO4/LiMO2(+)
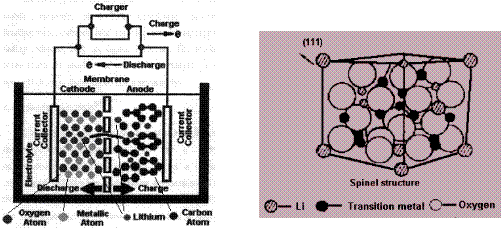
⑴写出锂电池充放电时的可逆电极反应。
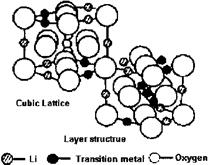
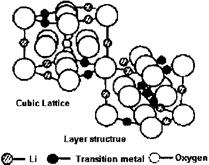
⑵根据上图所示的LiMO2的尖晶石结构,写出氧的堆积方式,并指出Li和M占据何种空隙,画出以氧为顶点的一个晶胞。
⑶锂离子在阳极与石墨形成固体混合物,试推测并画出锂离子嵌入石墨的可能结构。
⑷早期的阳极材料用的是锂金属,试指出锂金属作阳极材料的不足,并说明还可以用什么物质替代石墨作阳极材料?
2、填空题 1)图3-16为干冰的晶胞结构,观察图形,确定在干冰中每个CO2分子周围有__________个与之紧邻且等距离的CO2分子。
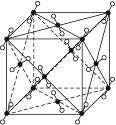
图3-16
在干冰中撒入镁粉,用红热的铁棒引燃后,再盖上另一块干冰,出现的现象为___________
_________,反应的化学方程式是______________________________。
(2)下列三种晶体①CO2 ②CS2 ③SiO2的熔点由高到低的顺序是__________>__________>__________(用序号填空),其原因是______________________________。
3、选择题 实现下列变化时,需克服相同类型作用力的是
A.二氧化硅和干冰的熔化
B.液溴和钠的气化
C.食盐和冰的熔化
D.纯碱和烧碱的熔化
4、填空题 (10分)如右图所示,晶体硼的基本结构单元都是由硼原子组成的正二十面体,这个多面体中含有20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。


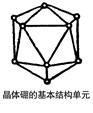

 (1)这个基本结构单元由?个硼原子组成,
(1)这个基本结构单元由?个硼原子组成,
 共含有?个B—B键。
共含有?个B—B键。



 (2)假设将此基本结构单元的每个顶角按一定比例且同等
(2)假设将此基本结构单元的每个顶角按一定比例且同等
 程度地削去(切点不重合),可得到另一个多面体,则此多面体含?
程度地削去(切点不重合),可得到另一个多面体,则此多面体含?
 个五边形,?个六边形。若再设此多面体的每个交点处有一个碳
个五边形,?个六边形。若再设此多面体的每个交点处有一个碳
 原子,这样就构成了碳元素形成的一种单质分子,此分子的分子式为?。
原子,这样就构成了碳元素形成的一种单质分子,此分子的分子式为?。
5、填空题 (13分)(1)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是__?___(请用相应的编号填写)

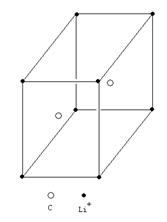
(2)一种离子晶体的晶胞如图。其中阳离子A以 表示,阴离子B以
表示,阴离子B以 表示。则每个晶胞中含A离子的数目为________,含B离子数目为________。若A的核外电子排布与Ar相同,B的核外电子排布与Ne相同,则该离子化合物的化学式是___________________;
表示。则每个晶胞中含A离子的数目为________,含B离子数目为________。若A的核外电子排布与Ar相同,B的核外电子排布与Ne相同,则该离子化合物的化学式是___________________;
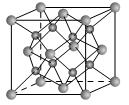
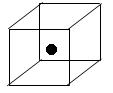
(3)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(4)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键
| Si—Cl
| H—H
| H—Cl
| Si—Si
|
键能/kJ·mol—1
| 360
| 436
| 431
| 176
|
已知:工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g)
则该反应的反应热△H = ?kJ/mol.
[-page来源:91考试网 www.91exAm.org-]
1、判断题 锂电池由于其安全可靠的性能,体积小、质量轻、高效能及可逆等卓越品质被广泛应用于移动电话、笔记本电脑、数码相机等便携式电子器材中。下图为锂电池工作原理图,阴极材料由LiMO2(M=Co,Ni,V,Mn)构成,阳极材料由石墨构成,阴、阳两极之间用半透膜隔开,充电时锂离子由阴极向阳极迁移,放电时则相反,电池可表示为:
(-)Cn/LiClO4/LiMO2(+)

⑴写出锂电池充放电时的可逆电极反应。
⑵根据上图所示的LiMO2的尖晶石结构,写出氧的堆积方式,并指出Li和M占据何种空隙,画出以氧为顶点的一个晶胞。
⑶锂离子在阳极与石墨形成固体混合物,试推测并画出锂离子嵌入石墨的可能结构。
⑷早期的阳极材料用的是锂金属,试指出锂金属作阳极材料的不足,并说明还可以用什么物质替代石墨作阳极材料?
参考答案:⑴ Cathode:? LiMO2=Li1-xMO2+xLi++xe
Anode:? nC+xLi++xe=LixCn
正反应为充电、逆反应为放电反应。(4分)
⑵ O:立方面心密堆积;Li和M占据八面体空隙;(1分)
以氧为顶点的一个晶胞表示如下:
 (2分)
(2分)
⑶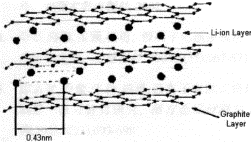 (3分)
(3分)
⑷锂活泼,易与电解质反应,形成锂的枝状晶体,导致电池被侵蚀或爆炸。(1分)
还可用低熔点的金属如Si,Bi,Pb,Sn,Cd等与锂掺杂形成金属合金,或用电解质如液体电解质LiPF6,LiBF6,LiAsF6及LiOSO2CF3(有机溶剂不能含水),以及固体电解质等。(1分)
本题解析:⑴该锂电池的充、放电过程是Li离子的嵌入与脱嵌的过程(因为充电时Li+由阴极向阳极迁移,放电时相反),电池内部载荷离子为Li+。因此充电时,
阳极: xLi++Cn+xe-→LixCn
阴极:LiMO2-xe-→Li1-xMO2+xLi+
放电时反应反方向进行。
⑵根据题意——LiMO2为尖晶石结构,该结构中,O2-呈面心立方密堆积,Li+和M交替地填满所有的八面体空隙。从图上可知,该种画法中M3+、Li+的原子分数坐标为:(0,0,0),(1/2,1/2,0),(1/2,0,1/2),(0,1/2,1/2)——即交替地分布于顶点和面心;而O2-的原子分数坐标为(1/2,0,0),(0,1/2,0),(0,0,1/2),(1/2,1/2,1/2),即棱心和体心的位置。因此坐标发生移,将O2-平移到晶胞顶点的位置后,M3+、Li+交替位于晶胞的棱心和体心的位置。如下图所示:
⑶Li+嵌入石墨的层状结构之间,碳原子与锂离子之间发生一定的静电作用,石墨体积稍微变大。最大程度地嵌入时,锂离子呈简单六方晶体,晶胞结构示意图如下:
⑷锂是活泼金属,因此易与电解质反应,形成锂的枝状晶体,导致电池被侵蚀或爆炸。能够代替石墨的材料至少要满足这几个条件:一是不能锂发生化学反应,二最好是层状结构,以便嵌入Li+,三是能导电。所以还可用低熔点的金属如Si,Bi,Pb,Sn,Cd等与锂掺杂形成金属合金,或用电解质如液体电解质LiPF6,LiBF6,LiAsF6及LiOSO2CF3(有机溶剂不能含水),以及固体电解质等。
本题难度:一般
2、填空题 1)图3-16为干冰的晶胞结构,观察图形,确定在干冰中每个CO2分子周围有__________个与之紧邻且等距离的CO2分子。

图3-16
在干冰中撒入镁粉,用红热的铁棒引燃后,再盖上另一块干冰,出现的现象为___________
_________,反应的化学方程式是______________________________。
(2)下列三种晶体①CO2 ②CS2 ③SiO2的熔点由高到低的顺序是__________>__________>__________(用序号填空),其原因是______________________________。
参考答案:(1)12 镁粉在干冰中继续燃烧,发出耀眼的白光,并有黑色物质生成
2Mg + CO2 2MgO + C
2MgO + C
(2)③ ② ① SiO2是原子晶体,CO2、CS2是分子晶体,所以SiO2熔点最高;CO2和CS2组成和结构相似,且CS2的相对分子质量大于CO2的相对分子质量,所以CS2的熔点高于CO2
本题解析:(1)以晶胞中的任意一个顶点为坐标原点,以通过该顶点的三条棱边为坐标轴建立起一个三维直角坐标系,在坐标原点的周围可以无隙并置8个晶胞,这样在每一个坐标轴上都可以看到有两个与坐标原点上的CO2分子等距离的CO2分子,但是这些CO2分子与坐标原点上的CO2分子的距离并不是最近的。与坐标原点上的CO2分子最近的CO2分子应该是每一个晶胞的面心上的,共有12个这样的CO2分子。
(2)一般来说,原子晶体的熔点高于分子晶体的熔点,因为原子晶体熔化时要破坏共价键,而分子晶体熔化时只是克服分子间作用力,分子间作用力比共价键弱得多。如果同为分子晶体,当分子的组成和结构相似时,相对分子质量越大,分子间作用力越大,熔沸点越高。
本题难度:简单
3、选择题 实现下列变化时,需克服相同类型作用力的是
A.二氧化硅和干冰的熔化
B.液溴和钠的气化
C.食盐和冰的熔化
D.纯碱和烧碱的熔化
参考答案:D
本题解析:二氧化硅是原子晶体,熔化克服的是共价键,干冰、液溴、冰形成的晶体都是分子晶体,熔化克服的是分子间作用力。氯化钠、纯碱和烧碱形成的都是离子晶体,熔化克服的是离子键,钠形成的晶体是金属晶体,熔化克服的是金属键,所以正确的答案选D。
本题难度:一般
4、填空题 (10分)如右图所示,晶体硼的基本结构单元都是由硼原子组成的正二十面体,这个多面体中含有20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。




 (1)这个基本结构单元由?个硼原子组成,
(1)这个基本结构单元由?个硼原子组成,
 共含有?个B—B键。
共含有?个B—B键。



 (2)假设将此基本结构单元的每个顶角按一定比例且同等
(2)假设将此基本结构单元的每个顶角按一定比例且同等
 程度地削去(切点不重合),可得到另一个多面体,则此多面体含?
程度地削去(切点不重合),可得到另一个多面体,则此多面体含?
 个五边形,?个六边形。若再设此多面体的每个交点处有一个碳
个五边形,?个六边形。若再设此多面体的每个交点处有一个碳
 原子,这样就构成了碳元素形成的一种单质分子,此分子的分子式为?。
原子,这样就构成了碳元素形成的一种单质分子,此分子的分子式为?。
参考答案:(1)12、30?(每空2分)
(2)12、20? C60?(每空2分)
本题解析:略
本题难度:简单
5、填空题 (13分)(1)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是__?___(请用相应的编号填写)

(2)一种离子晶体的晶胞如图。其中阳离子A以 表示,阴离子B以
表示,阴离子B以 表示。则每个晶胞中含A离子的数目为________,含B离子数目为________。若A的核外电子排布与Ar相同,B的核外电子排布与Ne相同,则该离子化合物的化学式是___________________;
表示。则每个晶胞中含A离子的数目为________,含B离子数目为________。若A的核外电子排布与Ar相同,B的核外电子排布与Ne相同,则该离子化合物的化学式是___________________;

(3)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。

(4)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键
| Si—Cl
| H—H
| H—Cl
| Si—Si
|
键能/kJ·mol—1
| 360
| 436
| 431
| 176
|
已知:工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g)
则该反应的反应热△H = ?kJ/mol.
参考答案:(13分)(1)(2分)BC?(2)(各2分)4、8、CaF2
(3)(2分)如图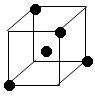 或
或
(4)(3分)+236
本题解析:略
本题难度:一般