微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去)。
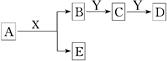
下列推断正确的是
A.若A是CaC2,X是H2O,则Y一定是溴水
B.若A是金属钠,X是H2O,则E一定能还原Fe2O3
C.若Y是NaOH,C是白色沉淀,则A与X一定发生置换反应
D.若Y是氧气,D是氧化物,则A与X一定发生氧化还原反应
参考答案:B
本题解析:A、若B是Ca(OH)2,Y是CO2,C是CaCO3,D是CaHCO3,转化也成立,错误;B、B是NaOH,Y是CO2,C是Na2CO3,D是NaHCO3,E是H2,正确;C、若A是Al2O3,X是HCl,B是AlCl3。Y是NaOH,C是Al(OH)3,D是NaAlO2,E是H2O,转化也成立,错误;D、若A是NH4Cl,X是NaOH , B是NH3,,Y是O2,C是NO,D是NO2,E是NaCl,转化也成立,错误。
本题难度:一般
2、填空题 下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素。已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
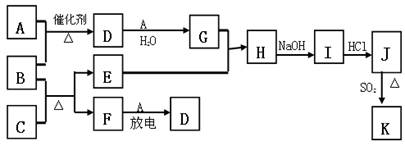
(1)B的电子式为?;
(2)写出B和C反应的化学方程式?;
(3)写出E与G的稀溶液反应的离子方程式,并用单线桥标出电子转移的方向和数目:
?;
(4)J、K均是同种金属的氯化物,且K为白色沉淀。写出SO2还原J生成K的离子方程式?;
(5)汽车尾气中常含有D和CO ,二者在催化剂作用下可以大部分转化为两种对空气无污染的物质,已知:? F(g) + A(g) =" 2D" (g)?△H =" +180.5KJ/mol"
2C (s)+ O2 (g)= 2CO(g)?△H =" -221.0" KJ/mol
C (s)+ O2(g) = CO2(g)?△H =" -393.5" KJ/mol
则上述尾气转化的热化学方程式为:?。
参考答案:(10分)(每小题各2分)
(1)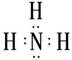
(2)3CuO + 2NH3 3Cu + N2 +3H2O
3Cu + N2 +3H2O
(3)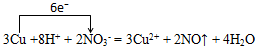
(4)2Cu2+ +2Cl-+ SO2 +2H2O =" 2CuCl↓+" 4H+ + SO42-
(5)2NO(g)+2CO(g)==N2(g)+2CO2(g)?△H= —746.5KJ/mol
本题解析:E为红色金属单质,即铜;刺激性气体B可与黑色氧化物生成铜与无色气体单质F可联想到反应:3CuO+2NH3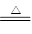 3Cu+N2+3H2O;无色气体单质A与氮气F“放电”生成D,即:2N2+O2
3Cu+N2+3H2O;无色气体单质A与氮气F“放电”生成D,即:2N2+O2 2NO;
2NO;
进而可知A与B是氨气的催化氧化:4NH3+5O2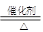 4NO+6H2O;NO氧化为G(硝酸):2NO+O2=2NO2、3NO2+H2O=2HNO3+NO;
4NO+6H2O;NO氧化为G(硝酸):2NO+O2=2NO2、3NO2+H2O=2HNO3+NO;
E(铜)与G(硝酸)的稀溶液反应:3Cu +8H+ + 2NO3- = 3Cu2+ + 2NO↑ + 4H2O
H为硝酸铜,与NaOH生成I:Cu(NO3)2+2NaOH=2NaNO3+Cu(OH)2↓;Cu(OH)2+2HCl=CuCl2+2H2O;J即为CuCl2;
CuCl2与SO2反应:2Cu2+ +2Cl-+ SO2 +2H2O =" 2CuCl↓+" 4H+ + SO42-
(1)B的电子式为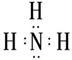
(3)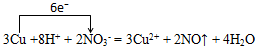
(4)CuCl2被SO2还原得到氯化亚铜沉淀,再根据电子得失、电荷、原子守恒可得离子方程式为:2Cu2+ +2Cl-+ SO2 +2H2O =" 2CuCl↓+" 4H+ + SO42-
(5)①N2(g) + O2(g) =" 2NO" (g)?△H = +180.5KJ/mol
②2C (s)+ O2 (g)= 2CO(g)?△H =" -221.0" KJ/mol
③C (s)+ O2(g) = CO2(g)?△H =" -393.5" KJ/mol
根据盖斯定律2×③-①-②可得:2NO(g)+2CO(g)==N2(g)+2CO2(g)?△H= —746.5KJ/mol
本题难度:一般
3、简答题 物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:

(1)A元素的原子结构示意图为______.
(2)写出下列物质的化学式:E是______,K是______.
(3)化合物B属于______化合物(填“离子”或“共价”).
(4)实验室检验J中所含的金属离子时,常在J的溶液中加入______溶液.
(5)写出反应“F→G”的化学方程式:______;
(6)写出反应“I→J”的离子方程式:______.
参考答案:K为红褐色沉淀,则应为Fe(OH)3,则溶液J中含有Fe3+,所以H为Fe,D应为H2,E应为Cl2,B为HCl,则I为FeCl2,J为FeCl3,K为Fe(OH)3,白色沉淀F能溶于过量NaOH溶液,则F为Al(OH)3,G为NaAlO2,A为Al,C为AlCl3,
(1)A为Al,原子核外有3个电子层,最外层电子数为3,则原子结构示意图为

,
故答案为:

;
(2)由以上分析可知E为Cl2,K为Fe(OH)3,故答案为:Cl2;Fe(OH)3;
(3)B为HCl,为共价化合物,故答案为:共价;
(4)J为FeCl3,加入硫氰化钾发生颜色反应,溶液呈红色,加入氢氧化钠溶液,生成氢氧化铁红褐色沉淀,
故答案为:硫氰化钾溶液或氢氧化钠溶液;
(5)F为Al(OH)3,G为NaAlO2,反应“F→G”的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(6)I为FeCl2,J为FeCl3,反应“I→J”的离子方程式为2Fe2++Cl2=2Fe2++2Cl-,
故答案为:2Fe2++Cl2=2Fe2++2Cl-.
本题解析:
本题难度:一般
4、推断题 A、B、C是单质,其中A是金属,各种物质间的转化关系如图:

根据图示转化关系回答:
(1)写出下列物质的化学式?。 A________,B________,乙_______,丁________。
(2)写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式______________________________。
②甲与NaOH溶液反应的离子方程式 ____________________________。
(3)将一定量的A加?入到NaOH溶液中,产生的C在标准状况下的体积为3.36?L,则消耗的A的物质的量为________,转移电子的物质的量为________。
参考答案:(1)Al;O2;NaAlO2;Al(OH)3
(2)①2Al+2NaOH+2H2O===2NaAlO2+3H2↑;②Al2O3+2OH-===2AlO2-+H2O
(3)0.1 mol;0.3 mol
本题解析:
本题难度:一般
5、推断题 某些物质的转化关系如下图所示(不是所有的产物都标出)。已知:
① 若用两根玻璃棒分别蘸取A的浓溶液和浓盐酸并使它们接近时,有大量白烟生成;
② 甲是由两种单质直接化合得到的一种淡黄色固体;
③ 乙为一种金属单质,常温下,它在浓硝酸钝化;
④ D溶液呈碱性,F为溶液。
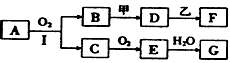
(1)A属于___________ A、电解质 B、非电解质
(2)请写出C、G的化学式: C____________ G________________
(3)请写出B与甲反应的化学方程式___________________________________,该反应中的氧化剂是___________(填化学式),还原剂是___________(填化学式);
(4)请写出D溶液与乙反应的化学方程式________________________________。
参考答案:(1)B
(2)NO;HNO3
(3)2Na2O2 + 2H2O === 4NaOH + O2↑;Na2O2;Na2O2
(4)2Al+2NaOH+2H2O===2NaAlO2+3H2↑
本题解析:
本题难度:一般